 |
| povera creatura immolata sull'altare de vaccini mRNA covid Pfizer - BionTech |
58 bambini che hanno ricevuto vaccini mRNA COVID-19 hanno subito eventi avversi potenzialmente letali
Leggi attentamente. Pfizer sta commettendo crimini contro l'umanità, in particolare contro i nostri figli.
Il vaccino ha provocato un arresto cardiaco non in una persona anziana ma in un bambino di due mesi.
“Perché non hanno seguito le condizioni del bambino di 2 mesi, dopo essere andato in arresto cardiaco un'ora dopo aver ricevuto un vaccino sperimentale? Perché non ci sono ulteriori informazioni? È perché è morto? O il bambino è stato rimosso da un esperimento? Perché l'autore del rapporto non dovrebbe menzionarlo?"
Chiediamo al Dipartimento di Giustizia degli Stati Uniti di avviare un'indagine penale contro Pfizer.
Chiediamo ai governi di tutto il mondo di sospendere immediatamente il vaccino mRNA.
È inoltre necessaria un'azione legale collettiva per conto delle centinaia di migliaia di vittime del vaccino mRNA.
Mai menzionato dai media, Pfizer ha precedenti penali presso il Dipartimento di Giustizia degli Stati Uniti.
Nel 2009 Pfizer è stata incriminata con l'accusa di "marketing fraudolento".
Un'analisi dei rapporti VAERS mostra che contrariamente al documento informativo della FDA che afferma che la maggior parte degli eventi avversi nello studio clinico di Pfizers non erano gravi: almeno 58 casi di effetti collaterali pericolosi per la vita in bambini di età inferiore a 3 anni che hanno ricevuto vaccini mRNA sono stati segnalati. Per alcuni, non è chiaro se siano sopravvissuti. Non è inoltre chiaro perché i bambini siano stati vaccinati e se facessero parte degli studi clinici. Tuttavia, nella prossima riunione della FDA di mercoledì, la FDA non potrà sostenere di non saperlo
Leggi attentamente. Pfizer sta commettendo crimini contro l'umanità, in particolare contro i nostri figli.
Il vaccino ha provocato un arresto cardiaco non in una persona anziana ma in un bambino di due mesi.
“Perché non hanno seguito le condizioni del bambino di 2 mesi, dopo essere andato in arresto cardiaco un'ora dopo aver ricevuto un vaccino sperimentale? Perché non ci sono ulteriori informazioni? È perché è morto? O il bambino è stato rimosso da un esperimento? Perché l'autore del rapporto non dovrebbe menzionarlo?"
Chiediamo al Dipartimento di Giustizia degli Stati Uniti di avviare un'indagine penale contro Pfizer.
Chiediamo ai governi di tutto il mondo di sospendere immediatamente il vaccino mRNA.
È inoltre necessaria un'azione legale collettiva per conto delle centinaia di migliaia di vittime del vaccino mRNA.
Mai menzionato dai media, Pfizer ha precedenti penali presso il Dipartimento di Giustizia degli Stati Uniti.
Nel 2009 Pfizer è stata incriminata con l'accusa di "marketing fraudolento".
Un'analisi dei rapporti VAERS mostra che contrariamente al documento informativo della FDA che afferma che la maggior parte degli eventi avversi nello studio clinico di Pfizers non erano gravi: almeno 58 casi di effetti collaterali pericolosi per la vita in bambini di età inferiore a 3 anni che hanno ricevuto vaccini mRNA sono stati segnalati. Per alcuni, non è chiaro se siano sopravvissuti. Non è inoltre chiaro perché i bambini siano stati vaccinati e se facessero parte degli studi clinici. Tuttavia, nella prossima riunione della FDA di mercoledì, la FDA non potrà sostenere di non saperlo
13 יוני 2022 | Ranit Feinberg e Yaffa Shir-Raz | inglese

- Mentre la FDA si prepara ad approvare il vaccino mRNA COVID-19 per neonati e bambini di età compresa tra 6 mesi e quattro anni e afferma nel suo documento informativo VRBPAC pubblicato oggi che la maggior parte degli eventi avversi riscontrati nello studio di Pfizers non erano gravi - L'analisi della rivista in tempo reale rivela almeno 58 eventi avversi pericolosi per la vita in neonati e bambini di età inferiore ai 3 anni segnalati a VAERS.
- Gli eventi avversi gravi più comuni sono stati emorragie pericolose per la vita, shock anafilattico, sindrome anticolinergica, encefalite, ipoglicemia e sindrome neurolettica. Nella maggior parte dei casi segnalati, si tratta di lesioni multisistemiche.
- In alcuni casi non è chiaro cosa sia successo ai bambini: sono sopravvissuti? E se si, si sono ripresi?
- La maggior parte dei rapporti non specifica in quali circostanze i bambini sono stati vaccinati e se hanno partecipato agli studi clinici.
- Mentre la FDA afferma nel suo documento informativo che l'efficacia del vaccino nei bambini è dell'80,4%, il documento rivela che l'affermazione si basa su un totale di 10 casi sintomatici di COVID-19 identificati nello studio tra 1415 partecipanti, 7 dei quali in il gruppo placebo vs. 3 nel gruppo vaccino.
"Dolore al petto; infarto; Pelle fredda e umida”. Questa breve descrizione di un arresto cardiaco, verificatosi un'ora dopo aver ricevuto un vaccino Pfizer-BioNTech COVID-19, è tratta dal sistema VAERS, il sistema di segnalazione degli eventi avversi del vaccino statunitense ( numero di caso 1015467), e non si riferisce a una persona anziana, né a un giovane adulto, e nemmeno a un adolescente. È difficile da credere, ma questo rapporto si riferisce a un bambino di due mesi. “Un paziente di sesso maschile di 2 mesi ha ricevuto bnt162b2 (PFIZER-BioNTech COVID-19 VACCINE) numero di lotto: EL 739, tramite una via di somministrazione non specificata il 02 febbraio 2021 a dose singola per l'immunizzazione COVID-19”, così affermato nel rapporto. “La vaccinazione somministrata al paziente, osservata per 15 minuti, ha lasciato la clinica e poi è tornata un'ora dopo, il 2 febbraio 2021, presentandosi come pelle fredda, umida e con dolore toracico, si è quindi sviluppato un evento di arresto cardiaco, il paziente si è stabilizzato e si è trasferito per ulteriori cure mediche... L'esito degli eventi era sconosciuto. Questo caso è stato segnalato come grave con criteri di gravità, in pericolo di vita da HA. Nessun tentativo di follow-up possibile. Non sono previste ulteriori informazioni”.
Come ha ricevuto il vaccino mRNA un bambino di 2 mesi? Questi vaccini non hanno ancora ricevuto l'EUA (Emergency Use Authorization) per l'uso approvato nei bambini di età inferiore a cinque anni dalla FDA o da qualsiasi altra autorità di regolamentazione, e anche se lo farà, l'EUA includerà solo bambini di età pari o superiore a 6 mesi.
Questo bambino ha partecipato agli studi clinici di Pfizer-BioNTech, che hanno testato l'efficacia e la sicurezza tra i bambini?
La risposta non è chiara. Secondo la persona che ha scritto il rapporto "Non sono sicuro che il paziente sia stato arruolato nella sperimentazione clinica". Tuttavia, l'autore del rapporto afferma anche che il rapporto è stato " ricevuto da un altro professionista sanitario contattabile da Pfizer dall'Agenzia di regolamentazione" . Questa nota implica che il bambino potrebbe aver effettivamente partecipato al processo di Pfizer. Il rapporto dell'agenzia di regolamentazione Safety Report Unique Identifier GB-MHRA-ADR 24687611 - indica che il rapporto proveniva dalla Gran Bretagna (le prime 2 lettere nell'ID del rapporto stanno per il paese di origine, GB-Gran Bretagna e MHRA indicano che la fonte di segnalazione era la sua 'autorità antidroga).
Perché non hanno seguito le condizioni del bambino di 2 mesi, dopo essere andato in arresto cardiaco un'ora dopo aver ricevuto un vaccino sperimentale? Perché non ci sono ulteriori informazioni? È perché è morto? O il bambino è stato rimosso da un esperimento? Perché l'autore del rapporto non dovrebbe menzionarlo?
Incredibilmente, si scopre che questo incidente non è isolato, ma in realtà uno dei tanti nel sistema VAERS, che descrive neonati e bambini sotto i cinque anni esposti a vaccini Covid mRNA, che hanno subito reazioni avverse pericolose per la vita.
Anche se i bambini sotto i cinque anni non sono stati considerati idonei per questi vaccini a meno che non facessero parte di una sperimentazione clinica, sorprendentemente, sembra che ci siano molti rapporti nel sistema che descrivono neonati e bambini piccoli che sono stati vaccinati. Alcuni dei bambini hanno sofferto di eventi avversi pericolosi per la vita. In alcuni casi, non è chiaro cosa sia successo loro; sono sopravvissuti e si sono ripresi, soffrono ancora di problemi di salute o sono morti.
Tra un paio di giorni, il 15 giugno, il comitato consultivo sui vaccini e sui prodotti biologici correlati della FDA discuterà le richieste EUA di Moderna e Pfizer per i vaccini per neonati e bambini di età compresa tra 6 mesi e 4 anni, l'unico gruppo non ancora idoneo alla vaccinazione COVID-19 oggi. Secondo il documento informativo della FDA rilasciato oggi prima della riunione dei comitati VRBPA, ci sono stati "245 rapporti statunitensi" al sistema VAERS "in bambini di età compresa tra 6 mesi e 4 anni", che sono stati iniettati ("prodotto somministrato a pazienti di età inappropriata" o "fuori- l'uso dell'etichetta") o esposti al vaccino "tramite il latte materno". Tuttavia, entrambe le società hanno annunciato già a maggio che i loro risultati indicano che i loro vaccini sono sicuri ed efficaci. Il documento informativo VRBPAC elenca una serie di eventi avversi segnalati a seguito dell'esposizione al vaccino in questa fascia di età, tra cui "piressia..., temperatura corporea..., tosse, mal di testa, eruzione cutanea, diarrea" . Secondo il documento, "Tra i rapporti VAERS statunitensi per individui di età compresa tra 6 mesi e 4 anni, che potrebbero riflettere l'uso non autorizzato del vaccino o potrebbero riflettere un errore di segnalazione, la maggior parte (96,3%) non era grave". Sebbene il documento specifichi i problemi di sicurezza identificati dai dati di sorveglianza della sicurezza post-autorizzazione in VAERS, tra cui anafilassi, miocardite e pericardite, non si riferisce a questi problemi di sicurezza identificati nel gruppo di età più giovane. Invece, afferma: "Non sono state identificate frequenze insolite, cluster o altre tendenze per eventi avversi che suggerirebbero un nuovo problema di sicurezza".
Ma è davvero così? Sembra che, indipendentemente dai risultati e nonostante i risultati inquietanti e scioccanti che vengono esposti dai documenti di Pfizer, si prevede che entrambe le società riceveranno molto presto l'EUA desiderata. Il sito del CDC, infatti, già ad aprile aveva pubblicizzato un protocollo riguardante la vaccinazione dei bambini , che prevedeva anche i bambini dai 6 mesi ai 4 anni.
Alla luce di questa attesa approvazione, RT Magazine ha condotto un'analisi dei casi segnalati nel sistema VAERS riferiti a bambini fino a 3 anni di età.
Durante l'analisi sono stati rimossi i casi in cui si affermava che l'esposizione al vaccino avveniva attraverso l'allattamento al seno (questi casi sono stati analizzati separatamente e saranno presto presentati in un articolo di follow-up), nonché i casi che sono stati identificati come errori di la registrazione dell'età.
L'analisi mostra che ci sono stati almeno 58 casi di reazioni avverse gravi e pericolose per la vita tra neonati e bambini di età pari o inferiore a 3 anni. Questa scoperta è particolarmente sconcertante considerando il fatto che all'inizio non avrebbero dovuto essere vaccinati a questa età. Purtroppo, analogamente al caso sopra riportato, la maggior parte dei rapporti VAERS non indica come e in quali circostanze sono stati esposti al vaccino: hanno partecipato agli studi delle aziende? E se no, perché e in quali circostanze sono stati vaccinati?
Entrambe le società non hanno ancora rilasciato i dati sulla sicurezza dei loro studi su questa fascia di età. Tuttavia, una cosa è chiara dai rapporti VAERS: ci sono stati molti bambini che sono rimasti feriti dopo aver ricevuto il vaccino. Indipendentemente dal fatto che siano stati vaccinati durante le prove o illegalmente nelle loro comunità, Pfizer e Moderna non potranno affermare con aria di sfida, quando presenteranno i loro dati alla FDA, che il vaccino è sicuro per i bambini e che non si sono verificati eventi avversi gravi in questa fascia di età. Inoltre, gli esperti del comitato della FDA che discuteranno dell'approvazione dell'EUA non potranno ignorare quei casi e sostenere che non lo sapevano. I dati presentati in questo articolo dimostrano al di là di ogni dubbio l'esatto contrario, e questa volta questi dati vengono presentati al pubblico in anticipo, prima che l'EUA sia concesso e prima della discussione sul VRBPAC.
L'esito degli eventi: non si è ripreso
Uno dei rapporti più agghiaccianti si riferisce a una bambina di 43 giorni, che il 30 gennaio 2021 ha ricevuto il vaccino Pfizer's Comirnaty. Nella descrizione dell'incidente (rapporto n. 1133837) si afferma chiaramente che è stata vaccinata e che il vaccino è stato iniettato nel muscolo: “Una paziente di 43 giorni ha ricevuto bnt162b2 (COMIRNATY), intramuscolare il 30 gennaio 2021 (Numero di lotto: EK9788) come DOSE SINGOLA per l'immunizzazione COVID-19” . Subito dopo la vaccinazione, il bambino ha subito una serie di lesioni multi-sistema pericolose per la vita, come “Reazione anafilattica (ampia), Asma/broncospasmo (stretto), Sindrome anticolinergica (ampia), Depressione respiratoria centrale acuta (ampia), Ipertensione polmonare (ampia), Cardiomiopatia (ampia), Polmonite eosinofila (ampia), Disturbi vestibolari (ampia) , Ipersensibilità (ampia), Insufficienza respiratoria (stretta), Reazione da farmaco con eosinofilia e sindrome da sintomi sistemici (ampia) ”. Sebbene nella sezione che riporta la morte la dichiarazione dica "No", la sezione che riporta la guarigione afferma anche "No", il che significa che il bambino non si è ripreso. Cosa le è successo allora? È viva o è morta?
Inoltre, questa relazione, come molte altre, solleva alcune questioni difficili. In che modo un bambino di 43 giorni ha ricevuto un vaccino non ancora approvato per l'uso nei bambini? Inoltre, gli attuali studi clinici condotti dovrebbero includere neonati e bambini di età superiore ai 6 mesi. Questo bambino ha partecipato al processo di Pfizers? La relazione non risponde a questa domanda.
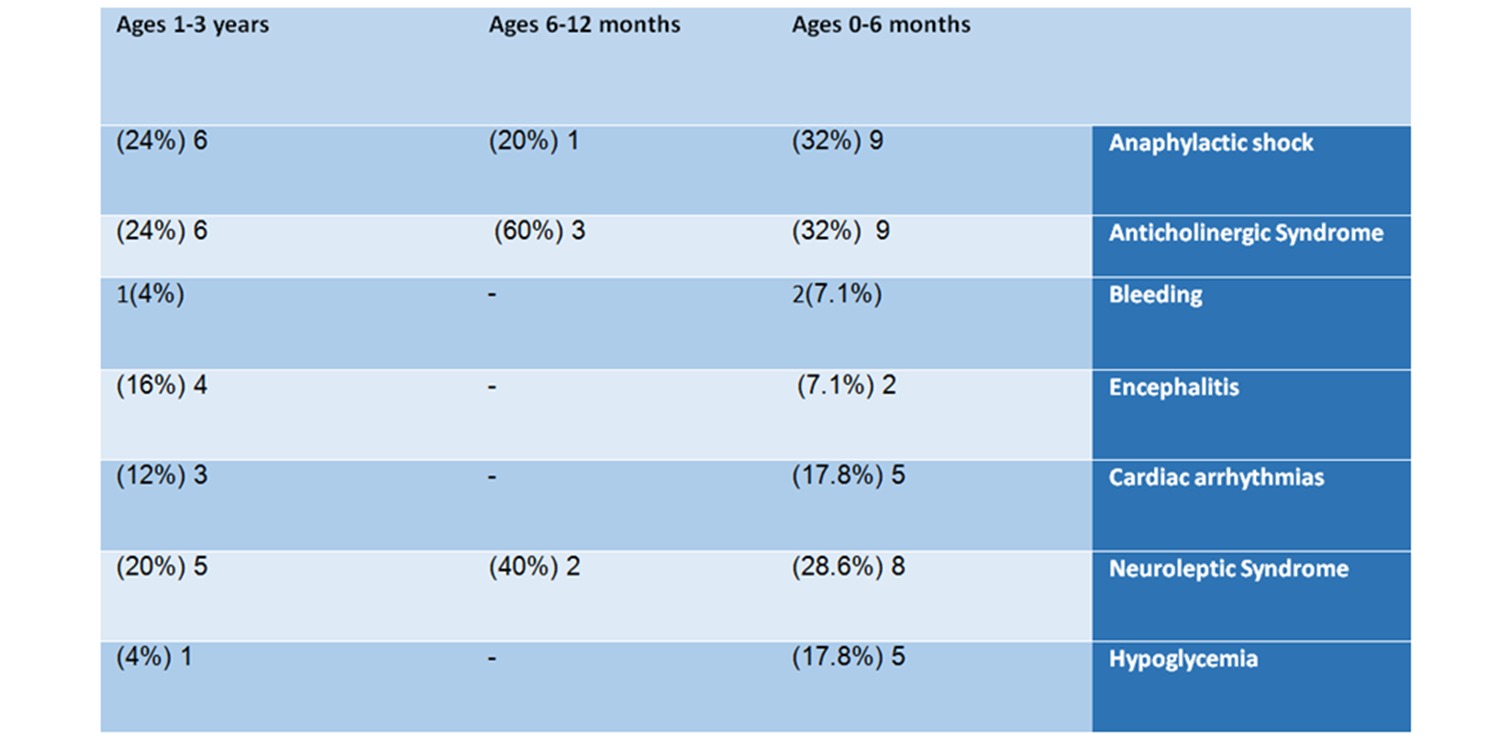
Proprio come questo bambino, si scopre che nella maggior parte dei casi segnalati sono stati registrati diversi effetti collaterali potenzialmente letali per lo stesso bambino. Gli eventi avversi gravi più comuni erano pericolose emorragie; shock anafilattico – un'allergia pericolosa per la vita che può danneggiare il sistema respiratorio e causare vertigini, svenimento e persino la morte; sindrome anticolinergica: una condizione che si verifica quando i siti recettoriali per il neurotrasmettitore acetilcolina sono bloccati, il che può portare a problemi di coordinazione, aumento della frequenza cardiaca e altri sintomi; encefalite – un'infezione cerebrale, che può causare mal di testa, vomito, perdita di coscienza e morte; ipoglicemia – livello di zucchero nel sangue molto basso, una condizione che può rapidamente degenerare fino alla morte nei bambini; e sindrome neurolettica – che è anche pericolosa per la vita e può danneggiare i muscoli del cuore, altri muscoli,
Dalla sintesi dei risultati dell'analisi per fasce di età e genere emerge il seguente quadro:
Nella fascia di età 0-6 mesi – ci sono 28 segnalazioni, in cui 10 sono maschi, 16 sono femmine e 2 il cui sesso non è stato specificato.
9 di loro (32%) soffrivano di una sindrome anticolinergica, 9 (32%) avevano uno shock anafilattico, 8 (28,6%) soffrivano di sindrome neurolettica, 5 soffrivano di irregolarità del ritmo cardiaco e 5 avevano ipoglicemia.
Nella fascia di età 6-12 mesi – in questo gruppo sono state riscontrate 5 segnalazioni – 3 maschi, una femmina e uno il cui sesso non era specificato. Questo gruppo è piccolo rispetto agli altri gruppi. L'elenco delle reazioni avverse includeva: shock anafilattico, sindrome anticolinergica e sindrome neurolettica.
Nella fascia di età da uno a tre anni – in questo gruppo sono stati segnalati 25 casi, di cui 5 relativi a maschi, 19 relativi a femmine e uno a un bambino il cui sesso non era specificato.
6 dei bambini (24%) avevano uno shock anafilattico, 6 (24%) soffrivano di sindrome anticolinergica, 5 (20%) soffrivano di sindrome neurolettica, 4 (16%) soffrivano di encefalite, 3 (12%) avevano battito cardiaco irregolare, uno il bambino aveva un'emorragia e uno soffriva di ipoglicemia.
Va notato che gli eventi avversi sopra elencati sono solo alcuni di quelli riportati in VAERS per quanto riguarda i bambini. Abbiamo scelto di concentrarci solo su eventi avversi comuni e pericolosi per la vita.
Tabella n. 1: Analisi delle segnalazioni per età e genere
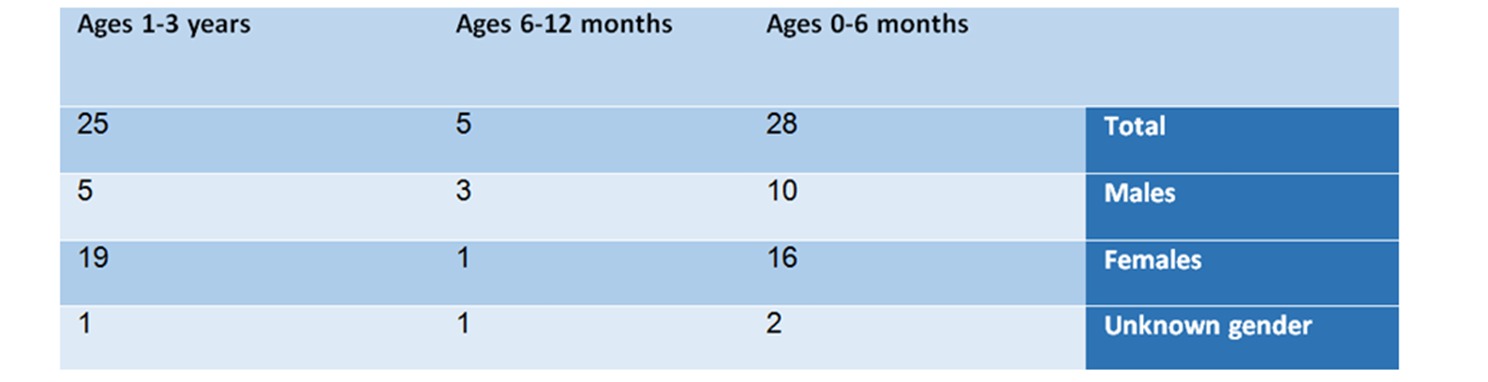
Tabella n. 2: Analisi delle segnalazioni per eventi avversi
I bambini sono vivi?
Analogamente al caso precedente descritto, anche un'altra bambina, di due mesi, ha subito shock anafilattico dopo essere stata esposta ad una singola dose del vaccino Pfizer-BioNTech il 6 gennaio 2021, e proprio come lei, secondo il rapporto (n. 976433), soffriva di una serie di sintomi multisistemici. Per quanto riguarda il metodo di somministrazione del vaccino, è stato affermato "tramite una via di somministrazione non specificata" , il che significa che non è chiaro in quali circostanze il bambino sia stato esposto al vaccino.
Faceva parte della sperimentazione clinica di Pfizers? Ancora una volta, non è chiaro dal rapporto.
Tuttavia, la domanda più importante da porsi, proprio come nel caso precedente, è cosa è successo al bambino? È sopravvissuta? È viva?
E ancora, nella sezione che riporta la morte, dice "No", il che significa che il bambino non è morto. Tuttavia, nella descrizione del rapporto si dice: "Il paziente non si era ripreso dall'evento. Nessun tentativo di follow-up possibile. Non sono previste ulteriori informazioni”.
È difficile da credere, ma questa domanda fondamentale – cosa è successo a un bambino dopo aver subito reazioni avverse così gravi e pericolose per la vita – nasce anche da altri casi gravi, come il caso di un bambino di 6 mesi (rapporto n. 2084418 ) che "ha ricevuto bnt162b2 (COMIRNATY), intramuscolare" il 29 dicembre 2021, e ha subito shock anafilattico, sindrome anticolinergica, sindrome neurolettica, polmonite infettiva, altre infezioni e sintomi multisistemici.
Anche in questo caso, la sezione che riporta la morte dice “No”, nel senso che presumibilmente il bambino non è morto, mentre nella descrizione dell'evento dice “esito 'sconosciuto'… Non sono possibili tentativi di follow-up. Non sono previste ulteriori informazioni”.
In un altro caso (rapporto n. 1012508) un bambino di un anno che ha ricevuto anche un vaccino Pfizer, il 19 gennaio 2021 (in questo caso si precisa che il bambino non ha preso parte a una sperimentazione) ha sviluppato un dolore in lei orecchio sinistro che è degenerato in una paralisi completa, a cui è stata diagnosticata la sindrome di Guillain Barre. Nella descrizione del caso si affermava che il bambino soffriva di Sindrome di Guillain Barre, paralisi facciale, encefalite non infettiva, meningite non infettiva, mal d'orecchi e disturbi dell'udito. Tuttavia, nella sintesi del rapporto, è stato scritto, ancora una volta, che “Non sono possibili tentativi di follow-up”.
E un altro caso scioccante (rapporto numero 1379484) emerge dal rapporto di un bambino che aveva solo un mese, che ha sofferto di "emorragia vaginale/emorragia vaginale pesante costante con frammenti di coagulo" il giorno successivo dopo aver ricevuto il vaccino Pfizer-BioNTech a maggio 19, 2021.
Sebbene i sintomi di cui soffriva il bambino fossero definiti “gravi in quanto clinicamente significativi” , nella descrizione dell'incidente si afferma che il risultato è “sconosciuto” e che “Non sono possibili tentativi di follow-up. Non sono previste ulteriori informazioni”.
Come accennato, in alcuni casi si afferma che i bambini non facevano parte di una sperimentazione clinica, mentre in altri non è chiaro se abbiano partecipato a una sperimentazione clinica o siano stati vaccinati in altre circostanze sconosciute. Ma che fossero o meno parte del processo, il rapporto non spiega l'assenza di queste informazioni critiche; cosa è successo a questi bambini? Sono sopravvissuti? E se sì, si sono ripresi? Perché non c'è stato un follow-up sulle condizioni mediche dei bambini che hanno sofferto di eventi avversi gravi e pericolosi per la vita, mentre è stato chiaramente affermato che non si sono ripresi? La FDA non richiede in casi così gravi che l'azienda faccia ogni sforzo per localizzare questi bambini, scoprire quali sono le loro condizioni e seguirli?
“Rossore nella zona di iniezione: il protocollo della sperimentazione clinica non menziona reazioni avverse gravi ”
Il comunicato stampa emesso l'11 febbraio 2022, in cui Pfizer-BioNTech ha annunciato l'intenzione di richiedere alla FDA l'approvazione per i bambini dai 6 mesi ai 4 anni di età, i risultati sulla sicurezza degli studi clinici dell'azienda su neonati e bambini piccoli a queste età non sono menzionate, nemmeno in una parola. L'opuscolo informativo relativo agli studi clinici che testano la sicurezza e l'efficacia del vaccino Pfizer negli adulti, bambini e neonati, sul sito web della FDA, afferma chiaramente "Nessun risultato dello studio pubblicato su ClinicalTrials.gov per questo studio". E come notato sopra, il documento informativo The VRBPAC appena pubblicato elenca solo una manciata di eventi avversi non gravi segnalati in questo gruppo di età, inclusi, e conclude che non c'è nulla che suggerisca un nuovo problema di sicurezza. Come potrebbe la FDA non essere a conoscenza di così tanti eventi avversi gravi che sono stati segnalati ai sistemi di segnalazione del CDC? In alternativa, se li conoscono, perché li stanno ignorando?
Come sono stati testati gli eventi avversi nei bambini rispetto agli studi clinici? Nel tentativo di rispondere a questa domanda critica, intesa ad affrontare i problemi di sicurezza e ad assicurare ai genitori che il vaccino è sicuro per i bambini, abbiamo esaminato il protocollo di studio trovato sul sito web della sperimentazione clinica della FDA.
Sembra che non siano stati elencati potenziali eventi avversi gravi. L'elenco dei potenziali eventi avversi che lo studio avrebbe dovuto valutare secondo il protocollo ("misura dell'esito") includeva reazioni sia locali che sistemiche. Tuttavia, si tratta di eventi avversi relativamente non gravi.
L'elenco degli eventi avversi locali che lo studio avrebbe dovuto monitorare include: "Dolore o dolorabilità al sito di iniezione, arrossamento e gonfiore" e le reazioni sistematiche includevano "Febbre, affaticamento, mal di testa, brividi, vomito, diarrea, nuova o peggiorata dolori muscolari, dolori articolari nuovi o peggiorati, diminuzione dell'appetito, sonnolenza e irritabilità”. Inoltre, sebbene la conclusione dello studio sia prevista solo per il 14 giugno 2024, il periodo di tempo fissato per l'esame degli eventi avversi è limitato a sette giorni dopo ciascuna delle dosi: la prima e la seconda dose.
Il vaccino è inefficace nei bambini. La soluzione: abbassare la soglia di efficienza e aggiungere una terza dose
Oltre alle sostanziali preoccupazioni per quanto riguarda la sicurezza dei vaccini per i bambini, la loro efficacia in questa fascia di età è generalmente discutibile. Secondo i dati disponibili, i bambini sani sono a rischio quasi zero di malattie gravi, ospedalizzazione o morte a causa di COVID-19.
Il ricovero per COVID-19 è molto raro tra i bambini e i casi di morte sono ancora più rari. In Germania, ad esempio, un ampio studio ha rilevato che nemmeno un bambino è morto di COVID-19 nella fascia di età 5-11 senza condizioni preesistenti. In queste circostanze, anche un solo caso di un evento avverso grave, per non parlare della morte, è cruciale e supera qualsiasi possibile beneficio del vaccino.
Non sorprende che gli studi clinici Pfizer su bambini sotto i 4 anni abbiano dimostrato che 2 dosi di vaccino non aumentano significativamente la loro conta anticorpale. Il commissario della FDA, la dott.ssa Janet Woodcock, ha ammesso in un'intervista all'inizio di aprile 2022 che "Gli anticorpi che sono stati sviluppati non erano così alti, quindi non hanno avuto la stessa risposta anticorpale alla serie a due colpi nei bambini più grandi. Non era così alto come avremmo sperato per i più piccoli come lo era per i più grandi”. Secondo Woodcock, questo è il motivo per cui Pfizer, che prevedeva di richiedere l'approvazione EUA per i bambini a febbraio, ha posticipato la data di presentazione e ha deciso di aggiungere una terza dose allo studio e di attendere i risultati dopo che tutti i bambini hanno ricevuto la terza dose.
Inoltre, in una dichiarazione rilasciata l'11 maggio, il dottor Peter Marks, direttore del Center for Biological Evaluation and Research presso la FDA, ha annunciato che i vaccini per neonati e bambini non dovranno superare il tasso di efficacia del 50% contro Covid. Un tasso di efficacia del 50% è la soglia che i vaccini per adulti devono superare. Tuttavia, Marks spiega che, nonostante le linee guida precedenti, la FDA non negherà ora alle aziende l'approvazione per neonati e bambini piccoli solo perché non ha raggiunto l'efficacia del 50% nella prevenzione delle infezioni sintomatiche.
Pfizer ha emesso un comunicato stampa il 23 maggio in cui annunciava che "l'efficacia del vaccino dell'80,3% è stata osservata nell'analisi descrittiva di tre dosi durante un periodo in cui l'Omicron era la variante predominante". Secondo il comunicato stampa, "Lo studio suggerisce che una bassa dose di 3-ug del nostro vaccino... fornisce ai bambini piccoli un alto livello di protezione contro i recenti ceppi di COVID-19".
Eppure, il documento informativo della FDA rivela che la richiesta di "alto livello di protezione" si basa su un totale di 10 casi sintomatici di COVID-19 identificati nel processo, che si sono verificati almeno 7 giorni dopo la dose 3. Tre di questi si sono verificati tra i partecipanti 6-23 mesi di età (che includeva 555 partecipanti – 376 nel gruppo vaccino e 179 nel gruppo placebo) – con 1 caso nel gruppo vaccino Pfizer-BioNTech e due nel gruppo placebo. Altri sette casi si sono verificati tra i partecipanti di età compresa tra 2 e 4 anni (che includevano 860 partecipanti – 589 nel gruppo del vaccino e 271 nel gruppo del placebo) – con 2 casi nel gruppo del vaccino Pfizer-BioNTech, rispetto a 5 nel gruppo del placebo. Tuttavia, l'efficacia del vaccino è stata inquadrata dalla FDA come 80,4%, e il documento conclude che "i dati disponibili supportano l'efficacia della serie primaria del vaccino Pfizer-BioNTech COVID-19 a 3 dosi (3 µg per dose) nella prevenzione del COVID-19 nella fascia di età da 6 mesi a 4 anni". Inoltre, il documento afferma che “Tra i neonati e i bambini di età compresa tra 6 mesi e 4 anni, i tassi di ospedalizzazione e morte per COVID-19 sono più elevati che tra i bambini e gli adolescenti di età compresa tra 5 e 17 anni e paragonabili a quelli di 18 anni 25 anni, sottolineando il beneficio di un efficace vaccino contro il COVID19 in questa fascia di età”.
Quanto è etico somministrare a un bambino un vaccino per una malattia che le possibilità di ammalarsi gravemente o di morire a causa di essa sono quasi zero, mentre i benefici del trattamento non sono chiari e le reazioni avverse pericolose per la vita sono molto significative?
Questa domanda è stata l'argomento di un articolo pubblicato a marzo di quest'anno su Bioetica . I ricercatori hanno affermato che nemmeno una delle principali affermazioni sostenute per giustificare l'approvazione per i bambini è valida. Secondo loro, i benefici del vaccino per i bambini sani sono minimi e quindi, anche se le complicanze sono rare, superano i benefici del vaccino, soprattutto perché non è chiaro quali siano i rischi a breve e lungo termine e l'esperienza con il vaccino è molto breve. Molto problematica è anche la pretesa altruistica di proteggere l'ambiente, poiché esistendo un vaccino i gruppi a rischio possono difendersi, ed è già stato dimostrato che i bambini non sono i principali trasmettitori del virus.
I membri del Congresso chiedono risposte
Questa questione etica è stata sollevata nei giorni scorsi da 18 membri del Congresso in una lettera inviata alla FDA il 7 giugno, chiedendo risposte prima della decisione dell'autorità di concedere un permesso di emergenza per il vaccino infantile. I membri del Congresso hanno chiesto di sapere perché i vaccini COVID-19 sono necessari per questa fascia di età alla luce del fatto che la malattia rappresenta un rischio molto piccolo per i neonati e i bambini piccoli, che i vaccini hanno poca efficacia e che ci sono molte domande senza risposta riguardo sicurezza ed eventi avversi di questi vaccini.
La lettera presenta 19 domande alla FDA, tra cui, tra le altre: perché la FDA ha ritardato la pubblicazione delle centinaia di migliaia di pagine di dati dagli studi dei produttori, lo stato degli eventi avversi e quando ci si può aspettare che tutti i dati della FDA essere reso pubblico? Alla FDA è stato anche chiesto di fornire al pubblico maggiori dettagli sui bambini gravemente feriti o morti a causa del COVID-19 e su quanti bambini in generale si sono ammalati gravemente. I legislatori hanno anche affrontato la questione dei rischi cardiaci nel somministrare i vaccini mRNA COVID-19 ai bambini, osservando che a seguito di vaccinazioni somministrate a un gran numero di bambini di età compresa tra 5 e 18 anni, è stato osservato un aumento di miocardite e pericardite, con alcuni casi che si sono conclusi con la morte, e gli effetti a lungo termine dell'infiammazione correlata al cuore non ancora quantificati dalle autorità sanitarie. Cosa c'è di più,

La FDA non potrà sostenere di non sapere
Come affermato, i dati emersi dall'analisi presentata in questo articolo dimostrano al di là di ogni dubbio che il vaccino non è sicuro per neonati e bambini piccoli. Indipendentemente dal fatto che questi bambini facessero parte dello studio o meno, questi rapporti sono stati nel sistema VAERS per molti mesi, quindi non c'è alcuna possibilità che la FDA non li conosca. Sfortunatamente, il fatto che la FDA fosse a conoscenza di almeno alcuni dei gravi eventi avversi, tra cui aumento del rischio di morbilità nei primi giorni dopo la vaccinazione, miocardite e aumento del rischio di aborto spontaneo e malformazioni fetali, e tuttavia abbia approvato il vaccino per adolescenti, bambini e donne incinte è stato poi rivelato troppo tardi, molto tempo dopo che l'EUA è stata concessa a Pfizer e Moderna, quando molti sono già stati danneggiati. È diventato chiaro solo grazie alle richieste FOIA (Libertà di informazione) presentate alla FDA e ad altre autorità sanitarie, e solo dopo che la FDA è stata costretta dal tribunale a divulgare i documenti. Questa volta, i dati VAERS qui presentati consentono di rivelare questo fatto anche prima dell'approvazione. La FDA non potrà affermare di non saperlo.
Nessun commento:
Posta un commento
grazie del tuo commento