 |
| peperoncino rosso - red chilli |

Annette C. Dolphin, REDATATORE ASSOCIATO
Informazioni sull'autore Informazioni su copyright e licenza Dichiarazione di non responsabilità di PMC
Vai a:
Abstract
Un gran numero di studi farmacologici hanno utilizzato la capsaicina come strumento per attivare molti sistemi fisiologici, con particolare attenzione alla ricerca sul dolore ma includendo anche funzioni come il sistema cardiovascolare, il sistema respiratorio e il tratto urinario. La comprensione delle azioni della capsaicina ha portato alla scoperta del suo recettore, il membro della sottofamiglia vanilloide 1 (TRPV1) del potenziale transitorio dei recettori (TRP), parte della superfamiglia dei recettori TRP, che rileva eventi esterni. Questo recettore si trova sulle principali afferenze sensoriali fini, quindi l'uso della capsaicina per attivare selettivamente le afferenze del dolore è stato sfruttato in studi su animali, psicofisica umana e studi di imaging. I suoi effetti dipendono dalla dose e dalla via di somministrazione e possono includere sensibilizzazione, desensibilizzazione, ritiro delle terminazioni nervose afferenti o persino morte palese delle fibre afferenti. La capacità della capsaicina di generare ipersensibilità centrale è stata preziosa per comprendere le conseguenze e i meccanismi alla base del potenziamento dell’elaborazione centrale del dolore. Inoltre, la capsaicina è stata utilizzata come agente terapeutico se applicata localmente e sono stati sviluppati antagonisti del recettore TRPV1. Nel complesso, i numerosi usi della capsaicina sono chiari; quindi, la logica di questa revisione è quella di riunire e discutere i diversi tipi di studi che sfruttano queste azioni per far luce sul funzionamento della capsaicina sia come strumento per comprendere il dolore ma anche come trattamento per il dolore cronico. Questa recensione discuterà le varie azioni della capsaicina e come si presta a questi diversi scopi.
Vai a:
I. Introduzione
Il Capsicum frutescens è un ortaggio di uso quotidiano e la sostanza capsaicina è responsabile del suo sapore caldo e speziato, ricercato in gastronomia. La capsaicina e diverse molecole correlate sono conosciute con il nome collettivo di capsaicinoidi e sono prodotte da tutte le piante del genere Capsicum , ad eccezione del peperone ( Capsicum annum ), che non produce capsaicina.
Il contenuto naturale di capsaicinoidi nelle spezie varia tipicamente da 0,1 mg/g nel peperoncino a 2,5 mg/g nel peperoncino e 60 mg/g nel peperoncino oleoresina (Parrish, 1996 ) . La capsaicina e la diidrocapsaicina sono i principali capsaicinoidi prodotti; tuttavia ne esistono altri e vengono prodotti in quantità minori. Sebbene gran parte della capsaicina si trovi nel frutto della pianta, i capsaicinoidi sono stati rilevati anche nel fusto e nelle foglie ( Estrada et al., 2002 ). La scala unitaria del calore Scoville (Fig. 1) viene utilizzato per classificare la forza dei peperoncini.
 |
| Fig. 1. La scala Scoville. La classificazione Scoville indica quanto è “piccante” un peperone, che dipende dal rispettivo contenuto di capsaicina. La capsaicina pura è più di 3 volte più calda dello spray al peperoncino utilizzato negli Stati Uniti e 200 volte più calda del jalapeno medio! |
Le differenze globali nel consumo giornaliero di spezie di peperoncino sono state segnalate pari a 2,5 g/persona in India, 5 g/persona in Tailandia ( Monsereenusorn, 1983 ), 15 g/persona in Arabia Saudita ( Al Othman et al., 2011 ) e 20 g/persona (un peperoncino) in Messico ( López-Carrillo et al., 1994 ).
A parte questo ruolo chiave nella cucina, numerosi studi di ricerca farmacologica e sul dolore hanno mostrato molteplici effetti della capsaicina in una varietà di sistemi fisiologici (dolore, cardiovascolare, respiratorio e urinario). Sebbene la capsaicina sia un composto ampiamente utilizzato, la complessità dell'azione sul suo recettore, il membro della sottofamiglia vanilloide potenziale del recettore transitorio 1 (TRPV1 1 ), è spesso sottovalutata.
La capsaicina può produrre una serie di effetti legati al dolore che dipendono dalla dose e dalla via di somministrazione. Gli effetti conseguenti possono essere sensibilizzazione, desensibilizzazione, ritiro delle terminazioni nervose afferenti o addirittura morte palese delle afferenze quando somministrate ad animali neonati.
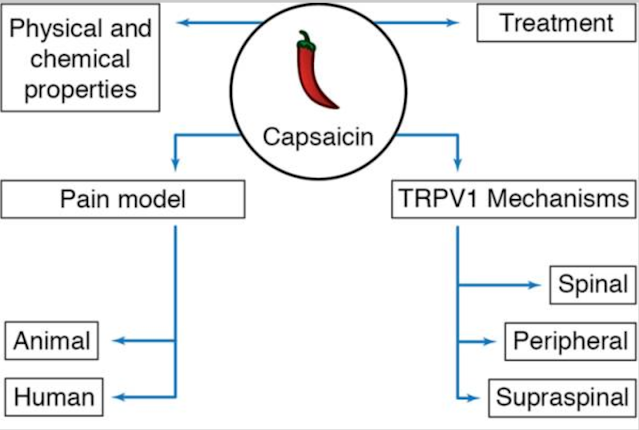
Questa recensione esplorerà innanzitutto le proprietà fisiche e chimiche della capsaicina, compresa la sua struttura, la farmacologia e, soprattutto, la farmacocinetica. Daremo quindi una breve panoramica dei canali ionici della famiglia TRP, che non solo è una delle famiglie più grandi ma è anche coinvolta in una miriade di processi fisiologici. Dalla loro scoperta nel 1969, sono stati ampiamente studiati in molti laboratori per chiarirne ruoli e meccanismi. Qui ci concentreremo sul recettore TRPV1 all’interno del percorso del dolore, necessario per il rilevamento del calore, dei protoni e, naturalmente, della capsaicina. Si trova nella periferia e nel midollo spinale, oltre ad alcuni siti sopraspinali. Questa recensione esamina la funzione, l'attivazione e la modulazione di ciascuno. Inoltre, vengono discusse le varianti di giunzione e i polimorfismi identificati sia negli animali che nell'uomo. Infine, viene esplorata l'espressione di TRPV1 nei tessuti umani periferici e viscerali.
Considereremo quindi l'uso della capsaicina in modelli di dolore sulla base della sua capacità di attivare afferenze sensoriali del dolore. Per comprendere la segnalazione tra le fibre periferiche e il sistema nervoso centrale, è importante essere in grado di valutare i ruoli di recettori, canali e molecole associate nei complessi processi che trasducono gli stimoli esterni in segnali elettrici e chimici. Gli input sensoriali dalla periferia terminano nel midollo spinale, dove si possono stabilire l'integrazione e l'ipersensibilità. Le uscite spinali corrono verso le strutture limbiche, dove si stabilisce la componente affettiva del dolore e parallelamente alle aree corticali attraverso il talamo, dove la mappatura codificante del corpo sulla corteccia e sull'omuncolo corticale consente di generare la localizzazione e l'intensità del dolore. Vengono quindi reclutati i centri del cervello importanti nelle risposte emotive e avversive al dolore. Questi centri nel cervello verranno attivati non solo dagli input nocicettivi ma anche da processi “dall’alto verso il basso”, come la paura, l’ansia e altri eventi della vita. I controlli discendenti dal mesencefalo e dal tronco encefalico consentono la regolazione del midollo spinale attraverso percorsi discendenti dal cervello (Figura 2).
 |
| Figura 2. Vie del dolore. Le fibre afferenti periferiche in entrata entrano nel DH del midollo spinale. I neuroni di proiezione spinale si estendono e fanno sinapsi in regioni come il talamo e il tronco encefalico. Da questi siti si realizzano anche interazioni con il sistema limbico e le strutture corticali. Le vie discendenti hanno origine nel RVM e nel PAG e possono agire sia sui neuroni di proiezione che sulle fibre afferenti per modulare il segnale del dolore. |
Negli esseri umani, la capsaicina è stata utilizzata in numerosi studi sperimentali sul dolore, dai modelli somatici a quelli viscerali; può essere utilizzato per valutare l'iperalgesia sia primaria che secondaria. Quest'ultimo è il risultato della sensibilizzazione centrale e imita i sintomi associati al dolore neuropatico, come allodinia, iperalgesia secondaria, area del dolore riferito e iperalgesia visceroviscerale. È stata studiata la riproducibilità di diversi modelli per verificarne l'utilità nello svelare azioni meccanicistiche o nel testare composti analgesici. I modelli di cui parleremo vanno dall’iniezione intradermica di capsaicina all’applicazione topica e alla somministrazione orale.
Un fenomeno interessante associato alla capsaicina sono i suoi effetti opposti dopo l'applicazione. Sebbene sia noto che causi dolore e sensibilizzazione sia dei nervi periferici che centrali, può anche portare alla desensibilizzazione e al ritiro delle fibre nervose epidermiche. Consideriamo i meccanismi alla base di queste azioni opposte, nonché il modo in cui l'effetto è determinato dal metodo di somministrazione, dall'applicazione ripetuta e dalla dose.
È importante riconoscere che le dosi di capsaicina utilizzate in vari studi comprendono un ampio intervallo. Ciò deriva dall'uso della capsaicina come agente sperimentale per attivare TRPV1 in diverse condizioni e con scopi diversi, come la sensibilizzazione o la desensibilizzazione. A causa di questi studi sperimentali, l’attivazione di TRPV1 in questo modo potrebbe non essere fisiologicamente rilevante. Le modalità applicative e le dosi utilizzate a livello terapeutico producono solo un effetto locale, evitando azioni sistemiche.
Infine, esaminiamo gli usi della capsaicina non solo come strumento investigativo ma anche come trattamento per una serie di disturbi del dolore neuropatico. Ad esempio, il cerotto all’8% è attualmente utilizzato nel trattamento di condizioni neuropatiche localizzate, come la nevralgia posterpetica (PHN). L'uso di un antagonista del TRPV1 è ancora una possibilità ma deve ancora essere utilizzato in clinica. Qui discutiamo sia dei trattamenti attuali che di quelli possibili futuri (Figura 3).
 |
| Figura 3. Usi della capsaicina. La capsaicina viene utilizzata sia come strumento di indagine sui meccanismi del dolore sia come trattamento per il dolore cronico. Attualmente, sebbene la scienza di base sfrutti gli effetti sensibilizzanti del composto, gli interventi farmacologici si basano solitamente sulla desensibilizzazione. |
Vai a:
II. Proprietà fisiche e chimiche della capsaicina
La capsaicina ( trans- 8-metil - N -vanillyl-6-nonenamide) è un alcaloide naturale derivato dalle piante del genere Capsicum , meglio conosciute come frutto del peperoncino. È un membro della famiglia dei composti vanilloidi (ad esempio, vanillina dalla vaniglia, eugenolo dalle foglie di alloro, chiodi di garofano e zingerone dallo zenzero) ( Hayman e Kam, 2008 ). Come altri vanilloidi, la capsaicina ha un anello benzenico e una lunga coda di carbonio idrofobo con un gruppo ammidico polare (Figura 4). La capsaicina è un composto idrofobo, incolore, inodore, cristallino con formula molecolare C 18 H 27 NO 3 ; il punto di fusione è 62–65°C e la massa molare è 305,4 g/mol ( Hayman e Kam, 2008 ; Reyes-Escogido et al., 2011 ). Poiché la capsaicina non è solubile in acqua, vengono utilizzati alcoli e altri solventi organici per solubilizzare la capsaicina nelle preparazioni topiche e negli spray. Questa liposolubilità probabilmente spiegherebbe perché un eccesso orale di capsaicina negli alimenti non viene alleviato dall’acqua potabile, mentre una bevanda a base di yogurt, come il lassi, è in grado di rimuovere il vanilloide dalla bocca.
Vai a:
II. Proprietà fisiche e chimiche della capsaicina
La capsaicina ( trans- 8-metil - N -vanillyl-6-nonenamide) è un alcaloide naturale derivato dalle piante del genere Capsicum , meglio conosciute come frutto del peperoncino. È un membro della famiglia dei composti vanilloidi (ad esempio, vanillina dalla vaniglia, eugenolo dalle foglie di alloro, chiodi di garofano e zingerone dallo zenzero) ( Hayman e Kam, 2008 ). Come altri vanilloidi, la capsaicina ha un anello benzenico e una lunga coda di carbonio idrofobo con un gruppo ammidico polare (Figura 4). La capsaicina è un composto idrofobo, incolore, inodore, cristallino con formula molecolare C 18 H 27 NO 3 ; il punto di fusione è 62–65°C e la massa molare è 305,4 g/mol ( Hayman e Kam, 2008 ; Reyes-Escogido et al., 2011 ). Poiché la capsaicina non è solubile in acqua, vengono utilizzati alcoli e altri solventi organici per solubilizzare la capsaicina nelle preparazioni topiche e negli spray. Questa liposolubilità probabilmente spiegherebbe perché un eccesso orale di capsaicina negli alimenti non viene alleviato dall’acqua potabile, mentre una bevanda a base di yogurt, come il lassi, è in grado di rimuovere il vanilloide dalla bocca.
 |
| Figura 4. La struttura molecolare della capsaicina. |
III. Farmacocinetica della capsaicina
La capsaicina può essere somministrata attraverso diverse vie, tra cui, negli esseri umani, l'esposizione all'ingrediente attraverso il consumo e in azioni di autodifesa (spray al peperoncino), nonché analgesici topici. Tuttavia, negli studi scientifici di base, i metodi principali sono le iniezioni intradermiche/intraplantari.
A. Amministrazione orale
La capsaicina viene assorbita mediante un processo non attivo dallo stomaco e dall'intero intestino ( Leelahuta et al., 1983 ; Kawada et al., 1984 ), dove la capacità di assorbimento totale varia tra il 50 e il 90% in diversi studi sugli animali ( Leelahuta et al., 1983 ; Kawada et al., 1984 ; Donnerer et al., 1990 ). La massima concentrazione nel sangue viene osservata 1 ora dopo la somministrazione ( Suresh e Srinivasan, 2010 ) (Figura 5). In una certa misura, la capsaicina viene assorbita nella sua forma intatta e la quantità nel sangue portale è misurabile marcando la capsaicina con la radioattività della [3H ] diidrocapsaicina ( Kawada et al., 1984 ; Donnerer et al., 1990 ). Tuttavia, il ruolo dell'assorbimento epiteliale intestinale è stato studiato in vivo quantificando la percentuale di diidrocapsaicina marcata immodificata nei ratti maschi, mostrando una diminuzione della diidrocapsaicina marcata immodificata con la via di passaggio del farmaco (lume gastrointestinale > sangue della vena porta > sangue del tronco e cervello) ( Donnerer et al., 1990). Inoltre, è stato riscontrato un aumento del numero di molecole intatte nel sangue della vena porta quando l'assorbimento avviene esclusivamente dallo stomaco rispetto all'assorbimento dallo stomaco e dall'intestino tenue, indicando il metabolismo di una parte minore di capsaicina e diidrocapsaicina nelle cellule epiteliali dell'intestino tenue, mentre nessun metabolismo si verifica nel lume intestinale ( Kawada et al., 1984 ; Donnerer et al., 1990 ).
La letteratura sulla capsaicina somministrata per via orale nell’uomo è scarsa. Un recente studio ha studiato a fondo il profilo farmacocinetico umano di 5 g di C. frutescens ingerito per via orale , equipotente a 26,6 mg di capsaicina pura (questo è l'equivalente di mangiare 15 peperoncini habanero!) ( Chaiyasit et al., 2009 ). Il gruppo ha documentato che la capsaicina poteva essere rilevata nel plasma dopo 10 minuti e che la concentrazione di picco ( Cmax ) era di 2,47 ± 0,13 ng/ml, il tmax era di 47,1 ± 2,0 min e il t1 /2 era di 24,9 ± 5,0 min ( Chaiyasit et al., 2009 ). Dopo 90 minuti, non è stato possibile rilevare la capsaicina ( Chaiyasit et al., 2009 ). Questi risultati lo suggerisconoBernard et al. (2008) non sono stati in grado di creare un profilo farmacocinetico dei capsaicinoidi dopo la somministrazione di 15 e 30 mg di capsaicina/persona, poiché hanno utilizzato un limite di rilevamento inferiore di 10 ng/ml. La capsaicina orale ha più rilevanza per la gastronomia molecolare che per qualsiasi opzione terapeutica.
B. Amministrazione sistemica
La somministrazione sistemica della capsaicina prevede sia metodi endovenosi che sottocutanei. Tre minuti dopo l'iniezione endovenosa negli animali, la capsaicina produce concentrazioni di capsaicina immodificata circa 5 volte più elevate nel cervello e nel midollo spinale rispetto al sangue ( Saria et al., 1981 ; Donnerer et al., 1990 ; Johnson, 2007 ). La concentrazione nel fegato era circa 3 volte superiore a quella nel sangue. Inoltre, dopo l'iniezione sottocutanea negli animali, la capsaicina può essere rilevata nel midollo spinale, nel cervello e nel plasma, come illustrato schematicamente inFigura 6( Dickenson et al., 1990 ; Donnerer et al., 1990 ). Per quanto ne sappiamo, non esistono segnalazioni di capsaicina somministrata per via endovenosa negli esseri umani; dati i probabili effetti avversi diffusi, va bene così.
C. Amministrazione topica
La maggior parte degli studi farmacocinetici sulla distribuzione della capsaicina sono quelli eseguiti dopo somministrazione topica a causa delle importanti implicazioni terapeutiche di questa via. L'assorbimento percutaneo in vitro di vanillilnonammidi (analoghi della capsaicina) negli animali è stato dimostrato nella pelle dorsale raccolta in ratti pelosi rasati e ratti "fuzzy" ( Kasting et al., 1997 ), esemplificando l'uso di questa via per fornire il vanilloide ai neuroni periferici .
La capsaicina topica negli esseri umani viene assorbita rapidamente e bene attraverso la pelle ( Hayman e Kam, 2008) e molte basse concentrazioni di capsaicina (0,025–0,1%) sono disponibili come creme o cerotti da banco. Uno studio su 12 soggetti ha valutato l'applicazione topica di soluzioni di capsaicina al 3% (55% capsaicina, 35% idrocapsaicina e 105 altri analoghi) utilizzando tre diverse preparazioni veicolo (alcool isopropilico al 70%, olio minerale e glicole propilenico contenente il 20% di alcol ). I capsaicinoidi sono stati rilevati nello strato corneo entro 1 minuto dall'applicazione e poco dopo è stato raggiunto uno stato stazionario. La concentrazione massima era quasi tre volte maggiore nei soggetti che avevano ricevuto alcol isopropilico al 70% rispetto alle preparazioni di olio minerale o glicole propilenico. L'emivita della capsaicina è di circa 24 ore ( Pershing et al., 2004 ; Hayman e Kam, 2008 ).
Un cerotto topico di capsaicina all'8% prescritto (NGX-4010) è stato introdotto ed etichettato per il trattamento del dolore, indicato per la gestione del dolore neuropatico associato alla nevralgia posterpetica. Il cerotto contiene 640 μg/cm 2 , il che significa che ogni cerotto contiene un totale di 179 mg di capsaicina ( Jones et al., 2011 ). Per determinare l’esposizione sistemica alla capsaicina dopo singole applicazioni di NGX-4010 da 60 o 90 minuti, sono stati raccolti campioni di plasma da 173 pazienti con PHN, neuropatia dolorosa associata all’HIV (HIV-AN) e neuropatia diabetica dolorosa (PDN). Le percentuali di pazienti con livelli quantificabili di capsaicina in qualsiasi momento erano del 31% per PHN (30/96), 7% per HIV-AN (3/44) e 3% per PDN (1/33). La concentrazione plasmatica massima osservata in ciascun paziente è stata di 17,8 ng/ml (Babbar et al., 2009 ). A causa del numero limitato di livelli quantificabili, è stata eseguita un'analisi della popolazione per caratterizzare la farmacocinetica (PK) della capsaicina. Le concentrazioni plasmatiche sono state adattate adeguatamente utilizzando un modello a un compartimento con assorbimento del primo ordine ed eliminazione lineare. I livelli di capsaicina sono diminuiti molto rapidamente, con un’emivita media di eliminazione nella popolazione di 1,64 ore. L'area media sotto la curva e i valori di Cmax dopo un'applicazione di 60 minuti erano rispettivamente 7,42 ng · ml −1 · h −1 e 1,86 ng/ml ( Babbar et al., 2009). Sono state osservate correlazioni tra i parametri PK calcolati e le caratteristiche del paziente. La durata e l'area di applicazione del cerotto sono state rilevate come covariate significative che spiegano la farmacocinetica della capsaicina. Applicazioni di 90 minuti di NGX-4010 hanno prodotto un'area sotto la curva della capsaicina e valori di Cmax circa 1,78 e 2,15 volte superiori a quelli osservati nei pazienti trattati per 60 minuti. Il trattamento sui piedi (pazienti con HIV-AN e PDN) ha prodotto un’esposizione sistemica molto inferiore rispetto al trattamento sul tronco (pazienti con PHN). È improbabile che la bassa esposizione sistemica e l'emivita di eliminazione molto rapida della capsaicina dopo la somministrazione di NGX-4010 provochino effetti sistemici e supportino il profilo di sicurezza complessivo di questo cerotto cutaneo sperimentale ( Babbar et al., 2009). L'uso medico della capsaicina topica (che, come dimostrano gli studi sopra citati, agisce quasi esclusivamente a livello locale periferico) è discusso più in dettaglio nella sezione XIV.
D. Somministrazione intradermica
Chanda et al. (2008) hanno studiato il metabolismo in vitro della capsaicina nella pelle umana e hanno scoperto che la biotrasformazione nella pelle umana era molto lenta. Durante l'incubazione, la capsaicina veniva metabolizzata lentamente nell'arco di 20 ore. Inoltre, sono stati rilevati due metaboliti, vanillilammina e acido vanillico.
Quando la capsaicina viene iniettata per via intradermica nell'uomo, è associata ad un dolore bruciante spontaneo che scompare in pochi minuti ( Jantsch et al., 2009 ). L'iniezione porta ad aree iperalgesiche primarie e secondarie. È stato segnalato che la sensibilità al calore è limitata ad un'area di circa 1 cm di diametro, centrata approssimativamente sul sito di iniezione. Inoltre, intorno al sito di iniezione si sviluppa un’area di iperalgesia dose-dipendente molto più ampia rispetto agli stimoli meccanici ( LaMotte et al., 1992).). Questo studio ha inoltre dimostrato una sensibilità dose-dipendente, con dosi più basse che portano alla sensibilizzazione e dosi più elevate alla desensibilizzazione: questo potrebbe spiegare la presenza di analgesia alla puntura di spillo nel sito di iniezione. Gli studi hanno riportato un gran numero di pazienti che non hanno risposto alla presenza di iperalgesia ( Park et al., 1995 ; Liu et al., 1998) Diverse variabili potrebbero essere responsabili di questa variazione; è quindi importante tenere presente che diversi fattori possono influenzare la dimensione dell'area [ad esempio, la dose, lo stimolo utilizzato per testare (dimensione dei capelli di von Frey, tampone di cotone, spazzola), tempo di valutazione e temperatura della pelle prima dell'iniezione ]. Tuttavia, il modello si è dimostrato affidabile e riproducibile ed è stato ampiamente utilizzato negli studi clinici che studiano il dolore e l’analgesia ( Staahl et al., 2009a , b ). In generale, la capsaicina intradermica viene utilizzata per indurre una sensibilizzazione centrale e un'alterata sensibilità al dolore, che verranno discusse nella sezione XII.
La capsaicina può essere somministrata attraverso diverse vie, tra cui, negli esseri umani, l'esposizione all'ingrediente attraverso il consumo e in azioni di autodifesa (spray al peperoncino), nonché analgesici topici. Tuttavia, negli studi scientifici di base, i metodi principali sono le iniezioni intradermiche/intraplantari.
A. Amministrazione orale
La capsaicina viene assorbita mediante un processo non attivo dallo stomaco e dall'intero intestino ( Leelahuta et al., 1983 ; Kawada et al., 1984 ), dove la capacità di assorbimento totale varia tra il 50 e il 90% in diversi studi sugli animali ( Leelahuta et al., 1983 ; Kawada et al., 1984 ; Donnerer et al., 1990 ). La massima concentrazione nel sangue viene osservata 1 ora dopo la somministrazione ( Suresh e Srinivasan, 2010 ) (Figura 5). In una certa misura, la capsaicina viene assorbita nella sua forma intatta e la quantità nel sangue portale è misurabile marcando la capsaicina con la radioattività della [3H ] diidrocapsaicina ( Kawada et al., 1984 ; Donnerer et al., 1990 ). Tuttavia, il ruolo dell'assorbimento epiteliale intestinale è stato studiato in vivo quantificando la percentuale di diidrocapsaicina marcata immodificata nei ratti maschi, mostrando una diminuzione della diidrocapsaicina marcata immodificata con la via di passaggio del farmaco (lume gastrointestinale > sangue della vena porta > sangue del tronco e cervello) ( Donnerer et al., 1990). Inoltre, è stato riscontrato un aumento del numero di molecole intatte nel sangue della vena porta quando l'assorbimento avviene esclusivamente dallo stomaco rispetto all'assorbimento dallo stomaco e dall'intestino tenue, indicando il metabolismo di una parte minore di capsaicina e diidrocapsaicina nelle cellule epiteliali dell'intestino tenue, mentre nessun metabolismo si verifica nel lume intestinale ( Kawada et al., 1984 ; Donnerer et al., 1990 ).
 |
| Figura 5. Farmacocinetica della capsaicina che mostra assorbimento, metabolismo e distribuzione dopo l'applicazione orale della capsaicina nei ratti (a sinistra) e nell'uomo (a destra). |
B. Amministrazione sistemica
La somministrazione sistemica della capsaicina prevede sia metodi endovenosi che sottocutanei. Tre minuti dopo l'iniezione endovenosa negli animali, la capsaicina produce concentrazioni di capsaicina immodificata circa 5 volte più elevate nel cervello e nel midollo spinale rispetto al sangue ( Saria et al., 1981 ; Donnerer et al., 1990 ; Johnson, 2007 ). La concentrazione nel fegato era circa 3 volte superiore a quella nel sangue. Inoltre, dopo l'iniezione sottocutanea negli animali, la capsaicina può essere rilevata nel midollo spinale, nel cervello e nel plasma, come illustrato schematicamente inFigura 6( Dickenson et al., 1990 ; Donnerer et al., 1990 ). Per quanto ne sappiamo, non esistono segnalazioni di capsaicina somministrata per via endovenosa negli esseri umani; dati i probabili effetti avversi diffusi, va bene così.
 |
| Figura 6. La distribuzione della capsaicina in vari tessuti dopo somministrazione sottocutanea nei ratti. I valori numerici si riferiscono alle concentrazioni dopo la distribuzione nel cervello, nel sangue e nella pelle. Nel caso del midollo spinale i valori si riferiscono alle concentrazioni dopo somministrazione locale. Poiché la somministrazione è sottocutanea, i valori non possono essere confrontati con i modelli sperimentali del dolore in cui la capsaicina viene somministrata per via intradermica. |
La maggior parte degli studi farmacocinetici sulla distribuzione della capsaicina sono quelli eseguiti dopo somministrazione topica a causa delle importanti implicazioni terapeutiche di questa via. L'assorbimento percutaneo in vitro di vanillilnonammidi (analoghi della capsaicina) negli animali è stato dimostrato nella pelle dorsale raccolta in ratti pelosi rasati e ratti "fuzzy" ( Kasting et al., 1997 ), esemplificando l'uso di questa via per fornire il vanilloide ai neuroni periferici .
La capsaicina topica negli esseri umani viene assorbita rapidamente e bene attraverso la pelle ( Hayman e Kam, 2008) e molte basse concentrazioni di capsaicina (0,025–0,1%) sono disponibili come creme o cerotti da banco. Uno studio su 12 soggetti ha valutato l'applicazione topica di soluzioni di capsaicina al 3% (55% capsaicina, 35% idrocapsaicina e 105 altri analoghi) utilizzando tre diverse preparazioni veicolo (alcool isopropilico al 70%, olio minerale e glicole propilenico contenente il 20% di alcol ). I capsaicinoidi sono stati rilevati nello strato corneo entro 1 minuto dall'applicazione e poco dopo è stato raggiunto uno stato stazionario. La concentrazione massima era quasi tre volte maggiore nei soggetti che avevano ricevuto alcol isopropilico al 70% rispetto alle preparazioni di olio minerale o glicole propilenico. L'emivita della capsaicina è di circa 24 ore ( Pershing et al., 2004 ; Hayman e Kam, 2008 ).
Un cerotto topico di capsaicina all'8% prescritto (NGX-4010) è stato introdotto ed etichettato per il trattamento del dolore, indicato per la gestione del dolore neuropatico associato alla nevralgia posterpetica. Il cerotto contiene 640 μg/cm 2 , il che significa che ogni cerotto contiene un totale di 179 mg di capsaicina ( Jones et al., 2011 ). Per determinare l’esposizione sistemica alla capsaicina dopo singole applicazioni di NGX-4010 da 60 o 90 minuti, sono stati raccolti campioni di plasma da 173 pazienti con PHN, neuropatia dolorosa associata all’HIV (HIV-AN) e neuropatia diabetica dolorosa (PDN). Le percentuali di pazienti con livelli quantificabili di capsaicina in qualsiasi momento erano del 31% per PHN (30/96), 7% per HIV-AN (3/44) e 3% per PDN (1/33). La concentrazione plasmatica massima osservata in ciascun paziente è stata di 17,8 ng/ml (Babbar et al., 2009 ). A causa del numero limitato di livelli quantificabili, è stata eseguita un'analisi della popolazione per caratterizzare la farmacocinetica (PK) della capsaicina. Le concentrazioni plasmatiche sono state adattate adeguatamente utilizzando un modello a un compartimento con assorbimento del primo ordine ed eliminazione lineare. I livelli di capsaicina sono diminuiti molto rapidamente, con un’emivita media di eliminazione nella popolazione di 1,64 ore. L'area media sotto la curva e i valori di Cmax dopo un'applicazione di 60 minuti erano rispettivamente 7,42 ng · ml −1 · h −1 e 1,86 ng/ml ( Babbar et al., 2009). Sono state osservate correlazioni tra i parametri PK calcolati e le caratteristiche del paziente. La durata e l'area di applicazione del cerotto sono state rilevate come covariate significative che spiegano la farmacocinetica della capsaicina. Applicazioni di 90 minuti di NGX-4010 hanno prodotto un'area sotto la curva della capsaicina e valori di Cmax circa 1,78 e 2,15 volte superiori a quelli osservati nei pazienti trattati per 60 minuti. Il trattamento sui piedi (pazienti con HIV-AN e PDN) ha prodotto un’esposizione sistemica molto inferiore rispetto al trattamento sul tronco (pazienti con PHN). È improbabile che la bassa esposizione sistemica e l'emivita di eliminazione molto rapida della capsaicina dopo la somministrazione di NGX-4010 provochino effetti sistemici e supportino il profilo di sicurezza complessivo di questo cerotto cutaneo sperimentale ( Babbar et al., 2009). L'uso medico della capsaicina topica (che, come dimostrano gli studi sopra citati, agisce quasi esclusivamente a livello locale periferico) è discusso più in dettaglio nella sezione XIV.
D. Somministrazione intradermica
Chanda et al. (2008) hanno studiato il metabolismo in vitro della capsaicina nella pelle umana e hanno scoperto che la biotrasformazione nella pelle umana era molto lenta. Durante l'incubazione, la capsaicina veniva metabolizzata lentamente nell'arco di 20 ore. Inoltre, sono stati rilevati due metaboliti, vanillilammina e acido vanillico.
Quando la capsaicina viene iniettata per via intradermica nell'uomo, è associata ad un dolore bruciante spontaneo che scompare in pochi minuti ( Jantsch et al., 2009 ). L'iniezione porta ad aree iperalgesiche primarie e secondarie. È stato segnalato che la sensibilità al calore è limitata ad un'area di circa 1 cm di diametro, centrata approssimativamente sul sito di iniezione. Inoltre, intorno al sito di iniezione si sviluppa un’area di iperalgesia dose-dipendente molto più ampia rispetto agli stimoli meccanici ( LaMotte et al., 1992).). Questo studio ha inoltre dimostrato una sensibilità dose-dipendente, con dosi più basse che portano alla sensibilizzazione e dosi più elevate alla desensibilizzazione: questo potrebbe spiegare la presenza di analgesia alla puntura di spillo nel sito di iniezione. Gli studi hanno riportato un gran numero di pazienti che non hanno risposto alla presenza di iperalgesia ( Park et al., 1995 ; Liu et al., 1998) Diverse variabili potrebbero essere responsabili di questa variazione; è quindi importante tenere presente che diversi fattori possono influenzare la dimensione dell'area [ad esempio, la dose, lo stimolo utilizzato per testare (dimensione dei capelli di von Frey, tampone di cotone, spazzola), tempo di valutazione e temperatura della pelle prima dell'iniezione ]. Tuttavia, il modello si è dimostrato affidabile e riproducibile ed è stato ampiamente utilizzato negli studi clinici che studiano il dolore e l’analgesia ( Staahl et al., 2009a , b ). In generale, la capsaicina intradermica viene utilizzata per indurre una sensibilizzazione centrale e un'alterata sensibilità al dolore, che verranno discusse nella sezione XII.
Vai a:
IV. Metabolismo della capsaicina
Si ritiene che il metabolismo della capsaicina dopo la somministrazione orale sia simile nei microsomi umani, di ratto e di cane. Quando la capsaicina e la diidrocapsaicina raggiungono il fegato, la maggior parte viene metabolizzata; tuttavia, la proporzione che subisce il metabolismo non è chiara. Esperimenti in vitro mostrano che la quantità di capsaicina e diidrocapsaicina è notevolmente ridotta dopo l'incubazione con omogenati di fegato ( Donnerer et al., 1990 ; Chanda et al., 2008 ). Esperimenti in situ sui ratti hanno dimostrato che la velocità di eliminazione intestinale della capsaicina e della diidrocapsaicina è approssimativamente uguale alla concentrazione di radioattività nel sangue venoso mesenterico, indicando che presumibilmente non ha luogo alcun metabolismo nel lume intestinale (Kawada et al., 1984 ) .
Un'indagine umana in vitro con microsomi epatici e frazioni S9 (utilizzate per studiare il coinvolgimento dei metabolici di fase 2), ha mostrato che la capsaicina veniva rapidamente metabolizzata, producendo tre metaboliti principali, 16-idrossicapsaicina, 17-idrossicapsaicina e 16,17-idrossicapsaicina, mentre la vanillina era un metabolita minore ( Chanda et al., 2008 ). Inoltre, Chanda et al. (2008)hanno stabilito un modello per chiarire il metabolismo della capsaicina a varie concentrazioni fisiologicamente equivalenti a quelle ottenute dopo l'ingestione orale di frutti di pepe. Hanno dimostrato che il metabolismo della capsaicina era meno esteso alla concentrazione di 10 μM rispetto a 1 μM (più del 50% di inibizione diretta di CYP1A2, CYP2C9 e CYP2C19) e gli autori suggeriscono quindi che la velocità del metabolismo è saturabile. Sebbene molti enzimi possano svolgere un ruolo nel metabolismo epatico dei farmaci, gli enzimi del citocromo P450 (P450) sono quantitativamente i più importanti e molte interazioni farmacologiche derivano dall’alterazione (aumento o diminuzione) delle attività di questi enzimi. Alle concentrazioni plasmatiche di capsaicina molto più basse che si verificano dopo la somministrazione topica, come tramite il cerotto all'8%, non è stata dimostrata l'inibizione diretta di alcun enzima P450. Poiché si ritiene che l'inibizione del CYP2E1 prevenga l'attivazione metabolica di numerosi agenti cancerogeni e poiché si ritiene che la capsaicina possieda proprietà antitumorali, è stato ampiamente dedotto che la capsaicina è un inibitore del CYP2E1. Questa implicazione, tuttavia, appare in una sola pubblicazione (Reilly e Yost, 2006 ). Non sono disponibili informazioni sulla capacità di nessuno di questi composti di modulare l'attività del P450 e, per quanto ne sappiamo, non sono note le azioni dei metaboliti 16-idrossicapsaicina e 17-idrossicapsaicina.
Studi in vitro sulla capsaicina nella pelle umana hanno mostrato una biotrasformazione lenta e la maggior parte della capsaicina rimane invariata; solo una piccola frazione viene metabolizzata in vanillilammina e acido vanillilico ( Chanda et al., 2008 ). Ciò suggerisce che gli enzimi del citocromo P450 partecipano in minima parte alla trasformazione della capsaicina nella pelle rispetto al loro ruolo chiave nel metabolismo epatico.
Vai a:
V. Eliminazione della capsaicina
Studi sugli animali hanno dimostrato che la capsaicina viene eliminata principalmente dai reni, con una piccola percentuale non trasformata escreta nelle feci e nelle urine ( Leelahuta et al., 1983 ; Kawada et al., 1984 ; Surh et al., 1995 ). Viene escreto sia in forma libera che in forma glucuronidica. Studi in vivo sugli animali hanno dimostrato che dopo 48 ore, solo una piccola quantità (<10%) della dose somministrata è stata trovata nelle feci ( Leelahuta et al., 1983 ; Kawada et al., 1984 ).
Vai a:
VI. Farmacologia della capsaicina
La capsaicina depolarizza i nocicettori e aumenta la loro concentrazione di Ca 2+ libero citosolico ( Dickenson et al., 1990 ). Il gene che codifica per il recettore della capsaicina è stato isolato utilizzando una strategia di espressione basata sull'imaging del Ca 2+ ( Caterina et al., 1997 ). È stato utilizzato un test di screening funzionale per isolare l'mRNA dal ganglio della radice dorsale (DRG) e creare una libreria di cDNA, che è stata divisa in pool di cloni e quindi trasfettata in cellule renali embrionali umane (293). I cambiamenti indotti dalla capsaicina nei livelli di calcio intracellulare sono stati misurati all'interno delle cellule renali embrionali umane 293 trasfettate e utilizzati per identificare il recettore vanilloide ( Caterina et al., 1997). Il recettore clonato è stato designato sottotipo 1 del recettore vanilloide, o membro 1 della sottofamiglia vanilloide potenziale del recettore transitorio, poiché una porzione vanilloide costituisce un componente chimico essenziale della capsaicina. È ormai noto che i capsaicinoidi esercitano i loro effetti attivando il recettore TRPV1 ( Hayman e Kam, 2008 ; Reyes-Escogido et al., 2011 ).
*****
continua sighit: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3462993/
Nessun commento:
Posta un commento
grazie del tuo commento