I documenti del tribunale rivelano che Merck era pienamente a conoscenza di un adiuvante aggiuntivo in Gardasil che non era stato divulgato ai destinatari e non aveva l'approvazione normativa.
Questa rivelazione solleva profonde preoccupazioni legali ed etiche in merito al consenso informato dei milioni di persone che hanno ricevuto Gardasil senza una conoscenza completa della sua composizione.
L'adiuvante non divulgato
Gli adiuvanti sono sostanze aggiunte ai vaccini presumibilmente per migliorare la risposta immunitaria.
In Gardasil, l'adiuvante a base di alluminio (AAHS) viene aggiunto per aiutare il sistema immunitario a riconoscere la proteina L1 presente nei ceppi di HPV.
Queste proteine L1 si autoassemblano in particelle simili a virus (VLP) che, se combinate con AAHS, costituiscono la formulazione del vaccino approvata.
Tuttavia, è stato dimostrato che Gardasil contiene anche miliardi di frammenti di DNA dell'HPV L1, che provengono dal plasmide di DNA sintetico utilizzato nella produzione.
I frammenti di DNA HPV L1 agiscono come un secondo adiuvante, che non è stato approvato, e rendono Gardasil molto più immunogenico rispetto a se i frammenti non fossero presenti.
Merck ne era a conoscenza e non lo ha reso pubblico.
Infatti, i documenti del tribunale rivelano che Merck ha preso deliberatamente misure per preservare e conservare questi frammenti di DNA HPV nella formulazione finale del vaccino.
Elaborazione di Gardasil
Durante la prima parte del processo di produzione, le cellule di lievito contenenti plasmidi di DNA sintetici vengono utilizzate per produrre proteine L1, che poi si assemblano in VLP.
Questa miscela viene poi filtrata per rimuovere i genomi di lievito più grandi, al fine di conservare le VLP.
Ma il brevetto di Merck rivela che è stato utilizzato un filtro da 0,65 micron, una dimensione sufficiente per catturare il DNA nucleare di lievito più grande ma troppo grande per intrappolare le VLP molto più piccole e il DNA HPV L1. È un po' come se le zanzare riuscissero a passare attraverso una rete metallica, mentre i detriti più grandi vengono catturati.

Successivamente, c'è la "fase di disassemblaggio-riassemblaggio" progettata per purificare ulteriormente le VLP. Rimuove qualsiasi DNA di HPV L1 sequestrato.
Tuttavia, la scoperta esplosiva nei documenti Merck, mostrata di seguito, è che in Gardasil4, la versione che prende di mira i tipi di HPV 6, 11, 16 e 18, le VLP contenenti DNA di HPV 18 vengono omesse da questa fase (vedere la freccia rossa).
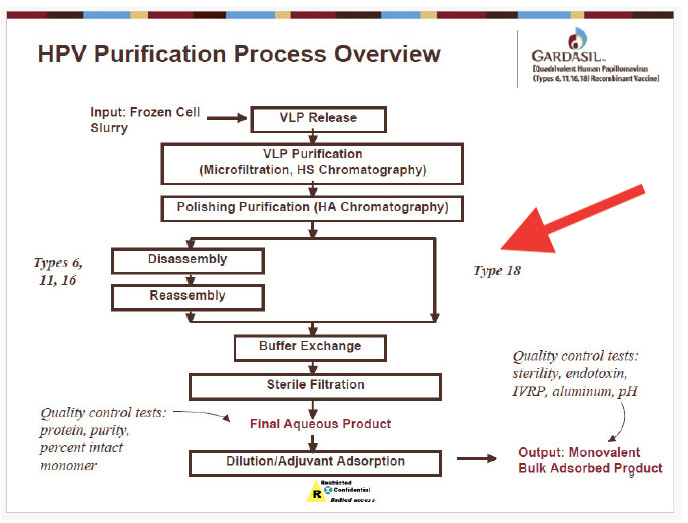
Di conseguenza, le VLP dell'HPV 18 mantengono la loro struttura sferica, proteggendo e preservando il DNA dell'HPV 18 L1. Ciò garantisce che rimanga nel prodotto acquoso finale (FAP).
Una volta aggiunto l'adiuvante di alluminio al FAP, tutti e tre i componenti (VLP, DNA virale e AAHS) si aggregano in precipitati stabili (come mostrato).
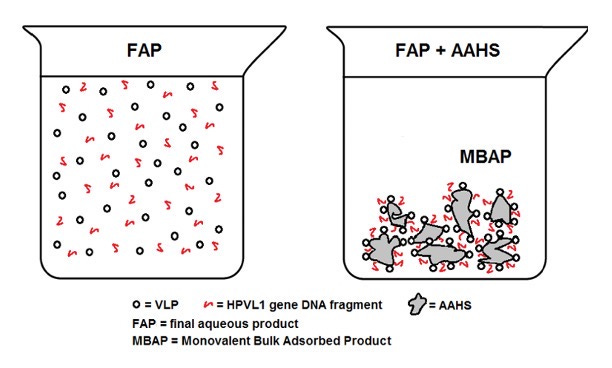
Intrappolato in questo precipitato, il DNA dell'HPV L1 è resistente alla degradazione enzimatica e protetto dalle difese naturali del corpo contro il DNA estraneo.
Conseguenze immunitarie del DNA dell'HPV
Il dott. Sin Hang Lee, patologo ed esperto in diagnostica molecolare, ha osservato nei documenti depositati in tribunale che, mentre la combinazione di VLP e AAHS innesca una risposta anticorpale, non genera una forte risposta immunitaria cellulare.
Tuttavia, la presenza di frammenti di DNA dell'HPV L1 attiva il recettore Toll-like 9 (TLR9), amplificando significativamente l'attività immunitaria.
Infatti, è noto che Gardasil stimola la risposta immunitaria oltre 50 volte in più rispetto a un'infezione naturale.
Tale attivazione immunitaria eccessiva e prolungata può portare a una perdita di "tolleranza immunitaria", ovvero il sistema immunitario non riesce a riconoscere il proprio tessuto come benigno, con conseguenti potenziali condizioni autoimmuni.
In alcuni individui, la cascata infiammatoria risultante è stata implicata nella sindrome da tachicardia posturale ortostatica (POTS) e, in rari casi, in esiti fatali.
Sfuggire all'approvazione normativa
L'industria dei vaccini sa da tempo che il DNA sintetico può migliorare l'attività adiuvante.
Nel 2022, Kaur e colleghi hanno osservato che "in alcuni casi, gli adiuvanti sono volutamente incorporati nell'antigene del vaccino per migliorare l'immunogenicità".
Ad esempio, gli oligodesossinucleotidi CpG (CpG ODN), molecole di DNA sintetico, sono approvati dalla FDA come adiuvanti in vaccini come Heplisav-B (per l'epatite B) e Cyfendus (per l'antrace).
Tuttavia, nessuna agenzia di regolamentazione al mondo ha approvato il DNA dell'HPV L1 come adiuvante.
Non solo Merck non è riuscita a ottenere l'approvazione, ma l'azienda ha anche attivamente nascosto la sua presenza.
Gli sforzi di Merck per nascondere il secondo adiuvante
Le e-mail interne presentate in tribunale espongono gli sforzi di Merck per sopprimere informazioni critiche.
Nel 2018, il ricercatore indipendente Stephen Tunley ha chiesto direttamente a CSL Behring Seqirus, il produttore australiano di Gardasil, se i frammenti di DNA dell'HPV fossero utilizzati per stimolare TLR9 e migliorare la risposta immunitaria.

La responsabile medica di CSL, la dott. ssa Debra Bourke, ha inizialmente redatto una bozza di e-mail in cui riconosceva che il DNA dell'HPV poteva agire come agonista del TLR9, potenziando la risposta immunitaria, sebbene negasse che il vaccino contenesse DNA virale.

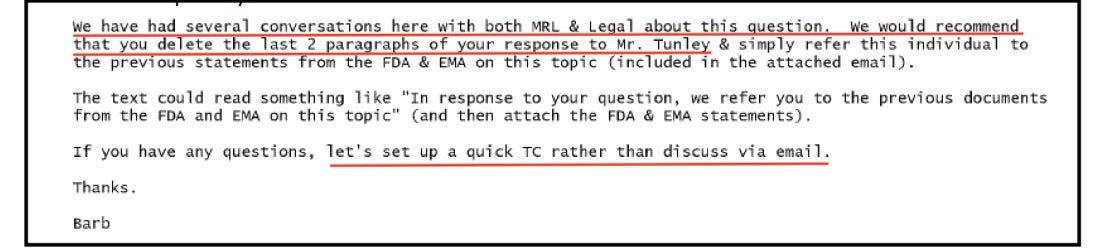
Quando il team legale di Merck ha esaminato la bozza, ha ordinato a CSL di rimuovere tutti i riferimenti al DNA e all'attivazione di TLR9.
Barbara Kuter [indicata come "Barb" nell'e-mail], che era un direttore esecutivo di Merck, ha ordinato al dott. Bourke di "eliminare gli ultimi 2 paragrafi" e ha consigliato che ulteriori richieste venissero gestite tramite telefono, piuttosto che tramite documentazione scritta.
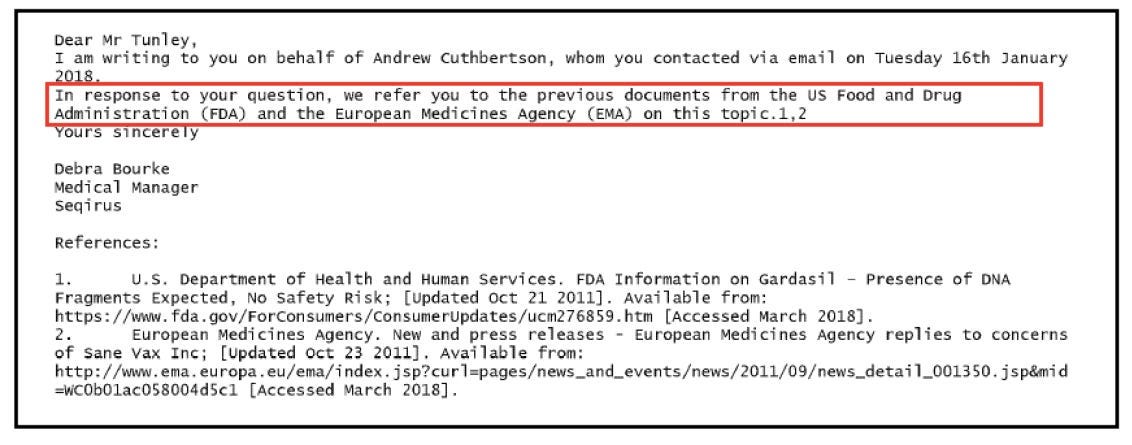
L'ultima e-mail inviata a Tunley era priva di qualsiasi informazione sostanziale, limitandosi a rimandare alle dichiarazioni generiche della FDA e dell'EMA disponibili online.
Etichetta del prodotto fuorviante e mancanza di consenso informato
Ancora oggi, le informazioni sul prodotto Gardasil distribuite da CSL Seqirus, dagli enti regolatori australiani ed europei, continuano a fuorviare il pubblico.
Il foglietto illustrativo europeo di Gardasil afferma esplicitamente che "le VLP non contengono DNA virale", un'affermazione falsa confutata dal dott. Lee già nel 2011.
Non rivelare la presenza di un adiuvante secondario non approvato viola la trasparenza e il consenso informato. Milioni di persone in tutto il mondo hanno ricevuto questo vaccino senza una conoscenza completa del suo contenuto o dei suoi potenziali effetti immunologici.
Questo non è solo un fallimento etico; potrebbe anche costituire una violazione legale. I pazienti avevano il diritto di essere informati sull'adiuvante secondario e sui rischi associati prima della vaccinazione.
Nonostante le ripetute richieste di commento, il professor Ian Frazer, co-inventore del vaccino HPV e australiano dell'anno 2006, non ha risposto alle richieste di informazioni su questo problema.
La strada da percorrere
Mentre questa causa ad alto rischio si svolge, evidenzia l'urgente necessità di una più forte supervisione normativa e responsabilità aziendale. I governi e le agenzie di sanità pubblica continuano a promuovere Gardasil, anche se aumentano le prove dell'inganno.
Il processo, tenutosi la scorsa settimana in un tribunale di Los Angeles, è stato ora rinviato a settembre 2025, lasciando domande cruciali senza risposta e molti in attesa di una risoluzione che determinerà se verrà fatta giustizia per i danneggiati dal vaccino.








Nessun commento:
Posta un commento