 Rappresentazione artistica di un nanorobot medico nel flusso sanguigno. Illustrazione: Christian Darkin/Alamy
Rappresentazione artistica di un nanorobot medico nel flusso sanguigno. Illustrazione: Christian Darkin/AlamyMo Costandi
https://www.theguardian.com/science/neurophilosophy/2015/mar/24/remote-control-brain-activity-nanoparticles
Due team di scienziati hanno sviluppato nuovi modi per stimolare i neuroni con nanoparticelle, consente loro di attivare le cellule cerebrali a distanza utilizzando campi luminosi o magnetici. I nuovi metodi sono più rapidi e molto meno invasivi rispetto ad altri metodi hi-tech disponibili, quindi potrebbero essere più adatti per potenziali nuovi trattamenti per le malattie umane.
I ricercatori hanno vari metodi per manipolare l'attività delle cellule cerebrali, probabilmente il più potente è l'optogenetica, che consente loro di attivare o disattivare specifiche cellule cerebrali con una precisione senza precedenti e di registrare contemporaneamente il loro comportamento , utilizzando impulsi di luce.
Questo è molto utile per sondare i circuiti neurali e il comportamento, ma comporta prima la creazione di topi geneticamente modificati con neuroni sensibili alla luce e quindi l'inserimento delle fibre ottiche che forniscono luce nel cervello, quindi ci sono importanti barriere tecniche ed etiche al suo utilizzo negli esseri umani .
La nanomedicina potrebbe aggirare questo problema. Francisco Bezanilla dell'Università di Chicago e i suoi colleghi sapevano che le nanoparticelle d'oro possono assorbire la luce e convertirla in calore, e diversi anni fa hanno scoperto che la luce infrarossa può far emettere impulsi nervosi ai neuroni riscaldando le loro membrane cellulari .
Hanno quindi attaccato nanotubi d'oro a tre diverse molecole che riconoscono e si legano alle proteine nelle membrane cellulari: la tossina dello scorpione Ts1, che si lega a un canale del sodio coinvolto nella produzione di impulsi nervosi, e gli anticorpi che legano i canali P2X3 e TRPV1 , entrambi trovati nei neuroni del ganglio della radice dorsale (DRG), che trasmettono le informazioni tattili e del dolore lungo il midollo spinale e nel cervello.
I ricercatori hanno aggiunto queste particelle ai neuroni DRG che crescono nelle capsule di Petri, in modo che si leghino alle cellule che mostrano le proteine rilevanti sulla loro superficie. Hanno quindi esposto le cellule a impulsi di luce visibile di millisecondi, che hanno riscaldato le particelle, facendo sì che le cellule emettano impulsi nervosi in risposta. Ciò è stato possibile non solo in neuroni isolati ma anche in fette di tessuto dell'ippocampo di ratto. In entrambe le situazioni, le particelle sono rimaste saldamente in posizione quando aggiunte a basse concentrazioni, consentendo una stimolazione ripetuta delle cellule per oltre mezz'ora.
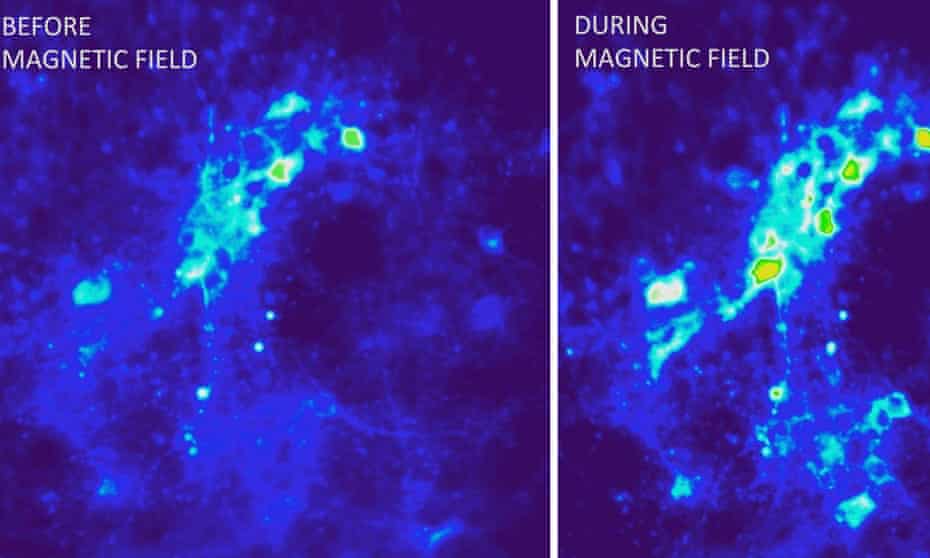
Il calore si dissipa dalle nanoparticelle di ossido di ferro in un campo magnetico alternato, innescando impulsi nervosi mediante l'attivazione dei canali TRPV1. Fotografia: Ritchie Chen/ Polina Anikeeva/ MIT
Il team di Polina Anikeeva al Massachusetts Institute of Technology ha adottato un approccio leggermente diverso, utilizzando particelle di ossido di ferro sferiche che emettono calore se esposte a un campo magnetico alternato.
In primo luogo, hanno iniettato un virus che trasporta il gene TRPV1 nel tegmento ventrale dei topi, in modo che i neuroni assorbano il virus ed esprimano il gene, rendendoli sensibili al calore. Un mese dopo, hanno iniettato le nanoparticelle nella stessa parte del cervello, e poi gli hanno applicato dei campi magnetici. Ciò ha fatto sì che le nanoparticelle emettessero calore sufficiente per attivare i canali TRPV1, facendo sì che i neuroni emettessero lunghi treni di impulsi nervosi.
I neuroni inghiottono nanoparticelle di ossido di ferro e i ricercatori hanno scoperto che le particelle che hanno iniettato persistevano nel cervello degli animali, in modo che potessero continuare ad attivare le cellule nel tegmento ventrale fino a un mese dopo, causando meno danni ai tessuti rispetto agli elettrodi impiantabili di acciaio inossidabile.
Entrambi i metodi sono piuttosto limitati nella loro specificità. Le nanoparticelle d'oro si legano solo ai molteplici tipi di cellule che esprimono il canale del sodio, P2X3 o TRPV1, mentre il virus TRPV1 e le particelle di ossido di ferro entrano nelle cellule in modo casuale intorno al sito di iniezione. Questo è facilmente risolvibile, poiché le nanoparticelle possono essere coniugate praticamente con qualsiasi molecola, ma mentre entrambi i metodi possono attivare i neuroni, nessuno dei due può inibirli, e non è affatto chiaro come potrebbero essere modificati per farlo.
Le nanoparticelle sono già utilizzate in altri campi. Possono, ad esempio, colpire e distruggere le cellule maligne e quindi mostrare risultati promettenti nella terapia del cancro . Più recentemente, alcuni ricercatori hanno sfruttato la loro capacità di intrufolarsi attraverso la barriera emato-encefalica e li hanno usati per visualizzare e ridurre i danni da ictus e l'infiammazione nei ratti.
Sebbene ancora nelle fasi sperimentali, ricerche come questa potrebbero eventualmente consentire una stimolazione cerebrale profonda wireless e minimamente invasiva del cervello umano. Il gruppo di Bezanilla mira ad applicare il proprio metodo per sviluppare trattamenti per la degenerazione maculare e altre condizioni che uccidono le cellule fotosensibili nella retina. Ciò implicherebbe l'iniezione di nanoparticelle nell'occhio in modo che si leghino ad altre cellule retiniche, consentendo alla luce naturale di eccitarle in impulsi di scarica al nervo ottico.
Riferimenti : Carvalho-de-Souza, JL, et al . (2015). Fotosensibilità dei neuroni abilitata da nanoparticelle d'oro mirate alle cellule. Neurone , DOI: 10.1016/j.neuron.2015.02.033
Chen, R., et al . (2015). Stimolazione cerebrale profonda magnetotermica wireless. Scienza , DOI: 10.1126/science.1261821 [ PDF ]
Il team di Polina Anikeeva al Massachusetts Institute of Technology ha adottato un approccio leggermente diverso, utilizzando particelle di ossido di ferro sferiche che emettono calore se esposte a un campo magnetico alternato.
In primo luogo, hanno iniettato un virus che trasporta il gene TRPV1 nel tegmento ventrale dei topi, in modo che i neuroni assorbano il virus ed esprimano il gene, rendendoli sensibili al calore. Un mese dopo, hanno iniettato le nanoparticelle nella stessa parte del cervello, e poi gli hanno applicato dei campi magnetici. Ciò ha fatto sì che le nanoparticelle emettessero calore sufficiente per attivare i canali TRPV1, facendo sì che i neuroni emettessero lunghi treni di impulsi nervosi.
I neuroni inghiottono nanoparticelle di ossido di ferro e i ricercatori hanno scoperto che le particelle che hanno iniettato persistevano nel cervello degli animali, in modo che potessero continuare ad attivare le cellule nel tegmento ventrale fino a un mese dopo, causando meno danni ai tessuti rispetto agli elettrodi impiantabili di acciaio inossidabile.
Entrambi i metodi sono piuttosto limitati nella loro specificità. Le nanoparticelle d'oro si legano solo ai molteplici tipi di cellule che esprimono il canale del sodio, P2X3 o TRPV1, mentre il virus TRPV1 e le particelle di ossido di ferro entrano nelle cellule in modo casuale intorno al sito di iniezione. Questo è facilmente risolvibile, poiché le nanoparticelle possono essere coniugate praticamente con qualsiasi molecola, ma mentre entrambi i metodi possono attivare i neuroni, nessuno dei due può inibirli, e non è affatto chiaro come potrebbero essere modificati per farlo.
Le nanoparticelle sono già utilizzate in altri campi. Possono, ad esempio, colpire e distruggere le cellule maligne e quindi mostrare risultati promettenti nella terapia del cancro . Più recentemente, alcuni ricercatori hanno sfruttato la loro capacità di intrufolarsi attraverso la barriera emato-encefalica e li hanno usati per visualizzare e ridurre i danni da ictus e l'infiammazione nei ratti.
Sebbene ancora nelle fasi sperimentali, ricerche come questa potrebbero eventualmente consentire una stimolazione cerebrale profonda wireless e minimamente invasiva del cervello umano. Il gruppo di Bezanilla mira ad applicare il proprio metodo per sviluppare trattamenti per la degenerazione maculare e altre condizioni che uccidono le cellule fotosensibili nella retina. Ciò implicherebbe l'iniezione di nanoparticelle nell'occhio in modo che si leghino ad altre cellule retiniche, consentendo alla luce naturale di eccitarle in impulsi di scarica al nervo ottico.
Riferimenti : Carvalho-de-Souza, JL, et al . (2015). Fotosensibilità dei neuroni abilitata da nanoparticelle d'oro mirate alle cellule. Neurone , DOI: 10.1016/j.neuron.2015.02.033
Chen, R., et al . (2015). Stimolazione cerebrale profonda magnetotermica wireless. Scienza , DOI: 10.1126/science.1261821 [ PDF ]





