Pfizer accusata di aver NASCOSTO i decessi durante le sperimentazioni del vaccino anti-COVID
Sono emerse nuove accuse schiaccianti dai ricercatori del DailyClout che hanno analizzato i dati degli studi clinici di Pfizer.
L'anestesista Dott. ssa Jeyanthi Kunadhasan e altri sostengono che la Pfizer ha nascosto la morte di una partecipante alla sperimentazione del Kansas, deceduta 41 giorni dopo aver ricevuto la seconda dose del vaccino.
La morte del partecipante, insieme ad altri gravi eventi avversi, sarebbero stati esclusi dalle discussioni critiche della FDA che hanno portato all'autorizzazione all'uso di emergenza del vaccino.
Inoltre, è stato scoperto che il tasso di segnalazione di decessi nel gruppo placebo era dell'80% (4 su 5), mentre era solo del 33% (2 su 6) nel gruppo vaccinato.
Questa discrepanza solleva una domanda critica: la Pfizer ha forse deliberatamente NASCOSTO i decessi per far apparire il suo vaccino più sicuro di quanto non fosse in realtà?
In un duro rimprovero, il cardiologo Dr. Aseem Malhotra ha reagito alle accuse contro Pfizer, affermando:
"Pfizer ha insabbiato le morti da vaccino, sostiene un team di ricerca. Questo è esattamente il motivo per cui ho coniato il termine 'determinanti psicopatici della salute'. Le prove indicano un crimine contro l'umanità da parte di un'entità psicopatica ..."In altre notizie, un giornalista ha ottenuto una copia di un rapporto nascosto da Pfizer, e i dati non sembrano buoni. Non c'è da stupirsi che non vogliano che tu veda questo:
Il rapporto nascosto di Pfizer mostra che le condizioni cardiache stanno PEGGIORANDO nel tempo
Pfizer non ha rivelato una "morte cardiaca improvvisa" causata da un vaccino del Kansas dal suo studio clinico sul COVID-19 -
Pfizer non ha rivelato una "morte cardiaca improvvisa" causata da un vaccino del Kansas dal suo studio clinico sul COVID-19
Lettera della dott.ssa Jeyanthi Kunadhasan al procuratore generale del Kansas Kris Kobach
4 dicembre 2024 •
di Jeyanthi Kunadhasan, MD (UKM), MMed (AnaesUM), FANZCA MMED (Monash)
Dott.ssa Jeyanthi Kunadhasan
Anestesista e medico perioperatorio
Progetto di analisi dei documenti Pfizer – Team 3
https://dailyclout.io/pfizer-did-not-disclose-a-kansas-vaccinated-sudden-cardiac-death-from-its-covid-19-clinical-trial-dr-jeyanthi-kunadhasans-letter-to-kansas-attorney-general-kris-kobach/?
Onorevole Kris Kobach
Procuratore generale del Kansas
120 SW 10th Ave, 2 ° piano
Topeka, Kansas 66612
4 dicembre 2024
OGGETTO: Morte non divulgata di un vaccinato del Kansas nel processo C4591001 presso il Vaccine and Related Biological Products Advisory Committee (VRBPAC) il 10 dicembre 2020
Egregio Procuratore Generale Kobach:
Mi chiamo Dott.ssa Jeyanthi Kunadhasan e sono un'anestesista e un medico perioperatorio in Australia. Sono anche un membro del team di volontari DailyClout che sta esaminando i dati, pubblicati sul sito web Public Health and Medical Professionals for Transparency[1], che hanno costituito la base dell'autorizzazione all'uso di emergenza (EUA) della Food and Drug Administration per il vaccino COVID-19 a mRNA BNT162b2 di Pfizer-BioNTech. Inoltre, sono tesoriere dell'Australian Medical Professionals Society.[2]
Ho co-scritto i report di analisi dei documenti Pfizer di WarRoom/DailyClout42[3] e76[4] , disponibile su dailyclout.io. Sono anche coautore di “Analisi forense dei 38 decessi di soggetti nel rapporto provvisorio di 6 mesi della sperimentazione clinica del vaccino mRNA BNT162b2 di Pfizer-BioNTech,”[5] che è la prima analisi dei dati originali del trial del vaccino mRNA BNT162b2 di Pfizer-BioNTech da parte di un gruppo non affiliato allo sponsor del trial clinico.
Ho notato con interesse la vostra causa contro Pfizer. Vorrei richiamare la vostra attenzione su un decesso non divulgato di un partecipante del Kansas, avvenuto nel braccio vaccinato con BNT162b2 della sperimentazione clinica di Pfizer, come originariamente riportato nel War Room/DailyClout Report 89, 'I ricercatori scoprono che Pfizer ha ritardato la registrazione dei decessi dei vaccinati in un momento critico del processo EUA. Ritardi impropri nella segnalazione dei decessi dei vaccinati hanno portato la FDA a dichiarare erroneamente l'efficacia del vaccino, influenzando la decisione di concessione dell'EUA.'[6]
Come saprete, i risultati dello studio clinico C4591001, che presumibilmente supportano la sicurezza e l'efficacia del vaccino a mRNA BNT162b2, sono stati pubblicati due volte. Polack et al. hanno pubblicato per la prima volta i risultati il 10 dicembre 2020, un giorno prima dell'emissione dell'EUA da parte della FDA, intitolata "Sicurezza ed efficacia del vaccino Covid-19 a mRNA BNT162b2”[7]. Quindi, il 15 settembre 2021, Stephen J. Thomas, MD, et al. hanno pubblicato, “Sicurezza ed efficacia del vaccino Covid-19 a mRNA BNT162b2 a 6 mesi.”[8] La pubblicazione Polack NEJM ha affermato, “Tutti i dati della sperimentazione erano disponibili a tutti gli autori, che ne garantiscono l’accuratezza e la completezza e l’aderenza della sperimentazione al protocollo, che è disponibile con il testo completo di questo articolo su NEJM.org. Un comitato indipendente di monitoraggio dei dati e della sicurezza ha esaminato l’efficacia e i dati di sicurezza non in cieco.” (Polack et al., 2020)
Il documento di Polack ha rivelato sei decessi : due nel braccio BNT162b2 e quattro nel braccio Placebo. Nell'articolo della rivista e nella documentazione di approvazione EUA[9], i sei decessi coprivano il periodo dal 27 luglio 2020 al 14 novembre 2020. Questa lettera dimostrerà che Pfizer-BioNTech possedeva registrazioni che mostravano che otto decessi , quattro nel braccio BNT162b2 e quattro nel braccio Placebo, avrebbero dovuto essere divulgati da Pfizer alla FDA. Inoltre, i due decessi non divulgati presentavano un segnale di evento cardiaco nei destinatari BNT162b2 della sperimentazione clinica. Uno dei decessi non divulgati nel braccio vaccinato della sperimentazione si è verificato in Kansas.
Il protocollo di sperimentazione clinica di Pfizer richiedeva che gli eventi avversi gravi (SAE) fossero segnalati immediatamente dopo la presa di coscienza e in nessun caso oltre le 24 ore, a Pfizer Safety sul Vaccine SAE Reporting Form.[10] Il protocollo richiedeva agli investigatori del sito di registrare nel Case Report Form (CRF) del paziente tutti gli eventi avversi osservati direttamente e tutti gli eventi avversi segnalati spontaneamente e gli eventi avversi gravi segnalati dal partecipante. In caso di decesso, ci si affidava al parente più prossimo/contatto di emergenza per informare un sito di sperimentazione clinica del decesso di un partecipante, a differenza dell'auto-segnalazione di altri eventi avversi. La tempestiva notifica allo sponsor della sperimentazione, da parte dell'investigatore del sito di sperimentazione clinica, di un SAE era essenziale per soddisfare gli obblighi legali e le responsabilità etiche in merito alla sicurezza dei partecipanti e alla sicurezza di un intervento di studio in fase di indagine clinica. Lo sponsor, in questo caso BioNTech, aveva la responsabilità legale di notificare sia all'autorità di regolamentazione locale che ad altre agenzie di regolamentazione la sicurezza dell'intervento di studio in fase di indagine clinica. Lo sponsor era tenuto a rispettare i requisiti normativi specifici del Paese in relazione alla segnalazione di sicurezza all'autorità di regolamentazione, ai comitati di revisione indipendente (IRB)/comitati etici (CE) e agli investigatori.
Quando osserviamo la tabella sottostante, che è adattata da "Analisi forense dei 38 decessi di soggetti nel rapporto intermedio a 6 mesi dello studio clinico sul vaccino a mRNA BNT162b2 Pfizer/BioNTech") (Michels et al., 2023), possiamo vedere che, fino alla data di cutoff dei dati del 14 novembre 2020, si sono verificati 11 decessi (sei decessi nel braccio vaccinato dello studio e cinque nel braccio placebo) in contrasto con i sei decessi resi pubblici alla riunione del VRBPAC e nell'articolo di Polack. Apparentemente c'era un tasso di cattura del 33% (due decessi segnalati su sei decessi) nel braccio vaccinato rispetto a un tasso di cattura dell'80% nel braccio placebo (quattro decessi segnalati su cinque decessi).
Per determinare come si sono verificate le discrepanze nei decessi segnalati, i miei colleghi ricercatori e io siamo partiti dal presupposto che, al 14 novembre 2020, Pfizer-BioNTech non fosse stata informata di alcun decesso durante la sperimentazione. L'unico modo in cui ciò poteva essere validamente confutato era dimostrare, tramite registri accessibili al pubblico, che Pfizer-BioNTech era a conoscenza dei decessi. Esaminando attentamente ciascuna delle note del paziente rilasciate dalla FDA e disponibili al pubblico sul sito Web Public Health and Medical Professionals for Transparency (PHMPT), abbiamo identificato i sei soggetti deceduti, i cui decessi sono stati segnalati nella pubblicazione iniziale di Polack e anche alla riunione del VRBPAC del 10 dicembre 2020. Si tratta dei soggetti vaccinati 11621327 e 10071101, nonché dei soggetti non vaccinati 11521085, 12313972, 10661350 e 10811194. I loro decessi sono avvenuti prima del 14 novembre 2020 ed era presente documentazione dei loro decessi prima del 14 novembre 2020 nei rispettivi CRF.
I due soggetti BNT162b2 i cui decessi sono stati inclusi nella presentazione dell'EUA:
I quattro soggetti trattati con placebo i cui decessi sono stati inclusi nella presentazione dell'EUA:
Dopo aver stabilito che Pfizer-BioNTech utilizzava l'inserimento dei dati della notifica di decesso nel CRF come unico punto dati per determinare se un decesso era stato segnalato, la nostra indagine sui registri pubblici di quel periodo non è stata in grado di fornire risposte sul motivo per cui gli altri decessi non erano stati segnalati.
Tuttavia, i dati Pfizer-BioNTech di settembre 2023 pubblicati dalla FDA hanno fornito un documento intitolato "125742_S1_M5_5351_c4591001-interim-mth6-narrativa-sensibile.pdf”[11] che includeva informazioni che mostravano che Pfizer-BioNTech era stata, di fatto, informata di due decessi aggiuntivi nel braccio BNT162b2 della sperimentazione ben prima del cutoff dei dati EUA e che tali decessi non erano stati divulgati alla FDA. Se i due decessi aggiuntivi fossero stati divulgati al momento dell'EUA, ciò avrebbe dimostrato che l'intervento del vaccino COVID mRNA BNT162b2 non aveva fornito alcuna riduzione dei decessi .
Il soggetto 11141050, una donna di 63 anni, si è iscritto alla sperimentazione del vaccino Pfizer (C4591001) presso l'Alliance for Multispecialty Research LLC, a Newton, Harvey County, 67114 Kansas. Il ricercatore principale in questo sito era il dottor Richard Glover.[12]
Il soggetto 11141050 era leggermente sovrappeso, con un BMI di 27. Era in postmenopausa, soffriva di depressione, ipertensione, osteoporosi, artrite reumatoide e apnea notturna. I suoi farmaci includevano trazodone (dal 1° gennaio 2005) e sertralina (dal 1° luglio 2020) per la depressione; pregabalin (dal 1° gennaio 2005) e baclofen (dal 1° gennaio 2018) per la malattia degenerativa del disco; così come amlodipina (dal 1° gennaio 2010) e idralazina (dal 1° febbraio 2020) per l'ipertensione.[13]
Dopo aver completato il processo di screening e i test appropriati, ha ricevuto la sua prima dose di BNT162b2 il 18 agosto 2020 e la seconda dose l'8 settembre 2020. Si è presentata per il follow-up di un mese, dopo la seconda dose, il 7 ottobre 2020 e in quel momento le sono stati eseguiti i test di follow-up appropriati.[14] Non vi è alcuna documentazione di eventi clinici indesiderati durante queste visite.
È morta 41 giorni dopo aver ricevuto la dose 2 di BNT162b2 il 19 ottobre 2020 e solo 12 giorni dopo la visita di controllo programmata. Il contatto di emergenza ha informato il sito clinico del decesso il 19 ottobre 2020. [15]
La morte di questo soggetto non è stata divulgata nella pubblicazione Polack NEJM (Polack et al., 2020), né durante la riunione del VRBPAC del 10 dicembre 2020.[16] Il protocollo di sperimentazione clinica della stessa Pfizer-BioNTech indicava che avrebbe dovuto essere divulgata.
Il decesso è avvenuto ben prima della data limite dei dati del 14 novembre 2020. Nelle narrazioni dei pazienti (Pfizer, 2023, p. 71), si può vedere che il contatto di emergenza ha confermato il giorno del decesso (19 ottobre 2020) che il soggetto era morto . I documenti narrativi affermano inoltre che il soggetto è stato sottoposto ad autopsia, da cui è stata determinata la causa della morte come "morte cardiaca improvvisa".
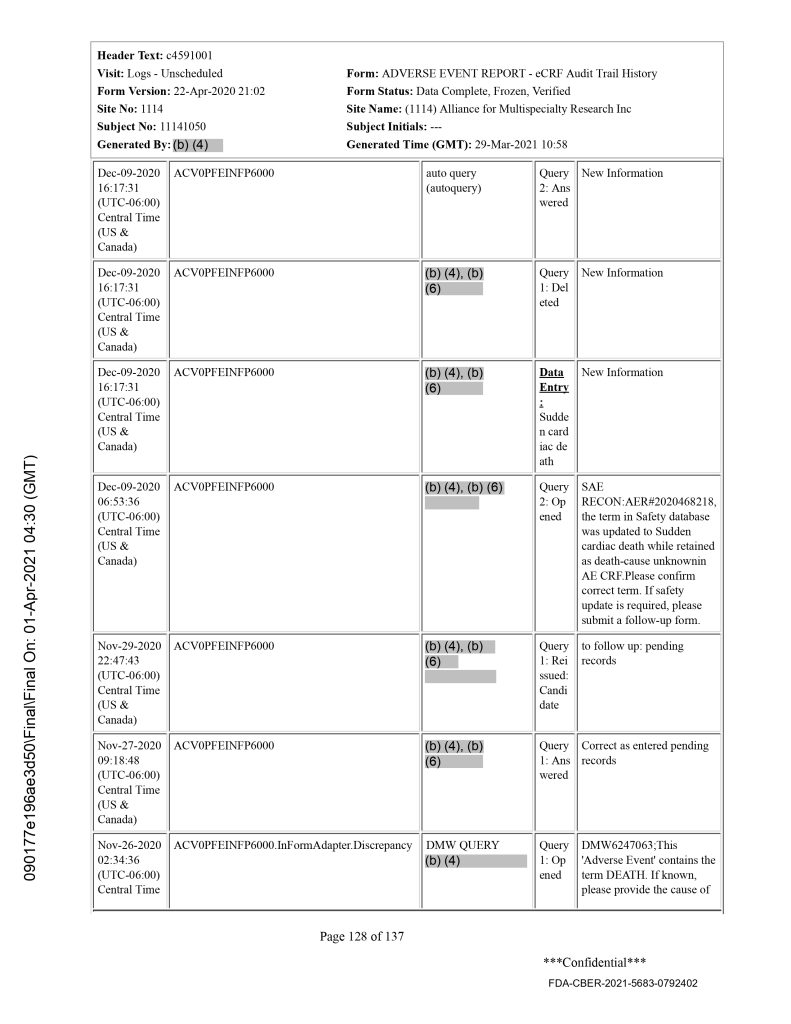
Quando ho esaminato il Case Report Form (CRF) di questo soggetto, ho scoperto che la diagnosi specifica di "morte cardiaca improvvisa" era stata menzionata il 9 dicembre 2020.[17] A pagina 71 del CRF di questo soggetto, la data di notifica del decesso è il 25 novembre 2020. Poiché il sito clinico era stato informato dal contatto di emergenza il giorno in cui il paziente è morto, vediamo che c'è stato un ritardo di 37 giorni nella registrazione di questo decesso nel CRF, in violazione del protocollo di sperimentazione di Pfizer. Poiché questo decesso si è verificato ben prima della data di interruzione dei dati del 14 novembre 2020 ed era noto il 25 novembre 2020, c'erano ampie opportunità di divulgare il decesso di questo soggetto, e possibilmente i risultati dell'autopsia, alla riunione del VRBPAC del 10 dicembre 2020.
Secondo l'autopsia, la paziente è morta per "morte cardiaca improvvisa", con i suoi noti fattori di rischio di ipertensione e obesità che la esponevano ad alto rischio di infarto miocardico acuto cardiaco. Il personale del sito clinico ha inserito la diagnosi specifica di "morte cardiaca improvvisa" nelle sue note il 9 dicembre 2020, il giorno prima della riunione del VRBPAC del 10 dicembre 2020, il che suggerisce che questa morte nascosta aveva anche i risultati dell'autopsia disponibili nel momento critico della considerazione dell'autorizzazione all'uso di emergenza del vaccino.
https://phmpt.org/wp-content/uploads/2023/09/125742_S1_M5_5351_c4591001-interim-mth6-narrative-sensitive.pdf pagina 71.
https://phmpt.org/wp-content/uploads/2023/05/125742_S1_M5_CRF_c4591001-1114-11141050.pdf#page=128, pag. 128.
Per essere ammissibili all'inclusione in questo studio clinico, i partecipanti dovevano essere considerati sani in base alla storia clinica, all'esame fisico (se richiesto) e al giudizio clinico dell'investigatore. Il protocollo ha consentito ai partecipanti sani con malattia stabile preesistente, definita come malattia che non richiedeva un cambiamento significativo nella terapia o l'ospedalizzazione per peggioramento della malattia durante le sei settimane precedenti l'arruolamento, di partecipare allo studio clinico. Questa paziente era stata curata con due diversi antipertensivi e aveva incontrato il personale dello studio clinico almeno tre volte senza alcuna menzione di letture di pressione sanguigna preoccupantemente elevate. Infatti, non riesco a trovare alcuna lettura della pressione sanguigna nelle sue note del caso disponibili al pubblico. Di conseguenza, posso solo supporre che l'ipertensione della paziente, di cui soffriva dal 1° gennaio 2010, fosse ben controllata quando è stata ammessa allo studio.
La paziente era alta 165 cm e pesava 74,1 kg. Quindi, il suo BMI di 27,2 la collocava nella categoria sovrappeso, non obesa. Senza esaminare i risultati dell'autopsia, sarà difficile credere che tali letture antropometriche mettano una persona ad alto rischio di morte cardiaca improvvisa.
https://www.phmpt.org/wp-content/uploads/2023/05/125742_S1_M5_CRF_c4591001-1114-11141050.pdf, pag. 10.
Sono necessarie ulteriori indagini sulla conclusione dello sponsor clinico secondo cui questa morte non divulgata nel braccio vaccinato non era dovuta al vaccino. Su quale base è stata presa questa decisione? Questo paziente ha un risultato dell'autopsia che non è ancora disponibile al pubblico. Questa autopsia non è stata divulgata nel momento più critico, prima dell'autorizzazione del farmaco. I risultati di questa autopsia devono essere resi pubblici per l'esame da parte di esperti indipendenti.
È estremamente importante sapereQuando il sito clinico 1114 ha ricevuto la notifica del decesso e se è stata effettuata una notifica tempestiva allo sponsor della sperimentazione clinica, Pfizer-BioNTech.
Quando è stata eseguita l'autopsia, chi è stato informato dei risultati della morte cardiaca improvvisa e quando.
Perché questo decesso (avvenuto ben prima del periodo di riferimento) e i risultati dell'autopsia non sono stati resi pubblici durante la riunione del VRBPAC del 10 dicembre 2020.
Di seguito è riportato un semplice diagramma schematico che evidenzia le date importanti per questo argomento di sperimentazione.
Ho esaminato più approfonditamente i decessi e le autopsie eseguite complessivamente nel trial. Il braccio vaccinato ha avuto 21 decessi e solo tre di questi (soggetti 11141050, 11271112 e 11351033) hanno subito autopsie.[18] Un'autopsia ha portato alla diagnosi di morte cardiaca improvvisa (soggetto 11141050) e gli altri due referti non sono ancora disponibili. Dieci dei 21 decessi nei soggetti vaccinati si sono verificati in coloro che sono stati trovati morti o hanno subito una morte improvvisa da adulti.[19] Di questi 10, solo due (soggetti 11141050 e 11271112) hanno subito autopsie, con un solo risultato dell'autopsia fornito (soggetto 11141050 - morte cardiaca improvvisa). Il risultato dell'autopsia per il soggetto vaccinato 11271112 è ancora in sospeso. Ci sono stati 17 decessi nel gruppo placebo e solo quattro (soggetti 11521085, 11561124, 11681083 e 12314987) sono stati sottoposti ad autopsia. Di questi, due (soggetti 11561124 e 11681083) hanno elencato una causa di morte. Gli altri due risultati non sono ancora disponibili.
Le autopsie, o meglio la mancanza di autopsie, in questo studio diventano più pertinenti considerando la revisione sistematica recentemente pubblicata dei risultati delle autopsie nei decessi dopo la vaccinazione contro il COVID-19. Ha rilevato che il 73,9% dei decessi è stato giudicato indipendentemente come direttamente dovuto alla vaccinazione, di cui la causa primaria di morte includeva la morte cardiaca improvvisa nel 35%. [20]
Voglio anche evidenziare un altro decesso non divulgato di un soggetto vaccinato. Il soggetto 11201050, di Meridian Clinical Research LLC, Savannah, Georgia, è morto il 7 novembre 2020. Le narrazioni del paziente affermano esplicitamente che il sito clinico ha ricevuto la notifica del decesso del soggetto il 7 novembre 2020 da suo marito(Pfizer2023, p. 75) . Questa informazione è ulteriormente supportata dalla documentazione trovata nel CRF di quel paziente che afferma chiaramente che la notifica di morte è avvenuta il 7 novembre 2020.[21]
Durante la riunione del VRBPAC del 10 dicembre 2020, una delle ragioni citate per l'approvazione del vaccino è stata che i benefici noti e potenziali del vaccino superano i rischi noti e potenziali del vaccino quando utilizzato per l'immunizzazione attiva per prevenire il COVID-19 causato da SARS-CoV-2 in individui di età pari o superiore a 16 anni (Comitato consultivo sui vaccini e sui prodotti biologici correlati, 2020). In particolare, l'omissione dei decessi e del rapporto dell'autopsia dal braccio vaccinato dello studio in questa fase critica dell'emissione dell'EUA solleva notevoli preoccupazioni sulla segnalazione complessiva della sicurezza della sperimentazione clinica di Pfizer. I pazienti che si sono offerti volontari per la sperimentazione clinica probabilmente lo hanno fatto, almeno in parte, al servizio dell'umanità. La mancata divulgazione dei decessi dei pazienti, nonostante la tempestiva notifica da parte dei propri cari, costituisce un tradimento del loro altruismo e della loro fiducia e merita ulteriori indagini. Solleva inoltre notevoli dubbi sui metodi di segnalazione complessivi. Questi metodi hanno portato a spese medico-finanziarie mai viste al mondo, e forse basate su premesse del tutto errate.
Sinceramente,
Dott.ssa Jeyanthi Kunadhasan
MD (UKM) MMed (AnaesUM) FANZCA MMED (Monash)
Note
[1] “Pfizer 16+ Documents.” Salute pubblica e professionisti medici per la trasparenza , Food and Drug Administration, 17 febbraio 2021,phmpt.org/pfizer-16-plus-documents/.
[2] “Australian Medical Professionals' Society: una società per i professionisti medici australiani.” AMPS , AMPS,amps.redunion.com.au/. Consultato il 31 dicembre 2023.
[3] Kunadhasan, Jeyanthi, et al. “Report 42: EUA di Pfizer concessa in base a meno dello 0,4% dei partecipanti alla sperimentazione clinica. La FDA ha ignorato le deviazioni del protocollo di squalifica per concedere l'EUA.” DailyClout , DailyClout, 26 settembre 2022,dailyclout.io/report-41-the-170-clinical-trial-participants-who-changed-the-world-pfizer-ignored-protocol-deviations-to-obtain-emergency-use-authorization-for-its-covid- Vaccino 19-mrna/.
[4] Kunadhasan, Jeyanthi e Ed Clark. “Report 76: Pfizer aveva i dati per annunciare la presunta "efficacia" del suo vaccino COVID-19 nell'ottobre 2020. Perché Pfizer ha ritardato l'annuncio fino al 9 novembre 2020, sei giorni dopo le elezioni presidenziali statunitensi del 2020?” DailyClout , DailyClout, 10 luglio 2023,dailyclout.io/report-76-pfizer-had-necessary-data-to-announce-its-covid-19-vaccines-alleged-efficacy-in-october-2020-why-did-pfizer-delay/.
[5] Michels, Corinne, et al. “Analisi forense dei 38 decessi di soggetti nel rapporto provvisorio di 6 mesi della sperimentazione clinica del vaccino Pfizer/Biontech Bnt162b2 Mrna.” International Journal of Vaccine Theory, Practice, and Research , International Journal of Vaccine Theory, Practice, and Research, 17 ottobre 2023,ijvtpr.com/index.php/IJVTPR/article/view/86.
[6]https://dailyclout.io/fda-granted-pfizer-eua-based-on-misrepresented-data/
[7] Polack, Fernando, et al. “Sicurezza ed efficacia del vaccino BNT162B2 Mrna Covid-19.” New England Journal of Medicine , nejm.org, 10 dicembre 2020,www.nejm.org/doi/full/10.1056/NEJMoa2034577.
[8] Thomas, Stephen J., et al. “Sicurezza ed efficacia del vaccino BNT162B2 Mrna Covid-19 a 6 mesi.” New England Journal of Medicine , nejm.org, 15 settembre 2021,www.nejm.org/doi/full/10.1056/NEJMoa2110345.
[9] Naik, Ramachandra, et al. “Memorandum di revisione dell’autorizzazione all’uso di emergenza del vaccino Pfizer-BioNTech COVID-19.” FDA , fda.gov, 20 novembre 2020,www.fda.gov/media/144416/download, pag. 19.
[10] Pfizer. “UNO STUDIO DI FASE 1/2/3, CONTROLLATO CON PLACEBO, RANDOMIZZATO, IN CIECO PER L'OSSERVATORE, PER VALUTARE LA SICUREZZA, LA TOLLERABILITÀ, L'IMMUNOGENICITÀ E L'EFFICACIA DEI CANDIDATI VACCINI A RNA SARS-COV-2 CONTRO IL COVID-19 IN SOGGETTI SANI.” Salute pubblica e professionisti medici per la trasparenza , PHMPT.org, 1 marzo 2022,phmpt.org/wp-content/uploads/2022/03/125742_S1_M5_5351_c4591001-fa-interim-protocol.pdf, pag. 74.
[11] Pfizer. “125742_S1_M5_5351_c4591001-Interim-Mth6-Narrative-Sensitive.Pdf.” Salute pubblica e professionisti medici per la trasparenza , phmpt.org, 1 settembre 2023,phmpt.org/wp-content/uploads/2023/09/125742_S1_M5_5351_c4591001-interim-mth6-narrative-sensitive.pdf.
[12]https://phmpt.org/wp-content/uploads/2021/11/5.2-listing-of-clinical-sites-and-cvs-pages-1-41.pdf#page=18.
[13]https://phmpt.org/wp-content/uploads/2023/09/125742_S1_M5_5351_c4591001-interim-mth6-narrative-sensitive.pdf, pag. 69.
[14]https://phmpt.org/wp-content/uploads/2023/05/125742_S1_M5_CRF_c4591001-1114-11141050.pdf, pag. 23.
[15]https://phmpt.org/wp-content/uploads/2023/09/125742_S1_M5_5351_c4591001-interim-mth6-narrative-sensitive.pdf, pag. 71.
[16] Comitato consultivo sui vaccini e sui prodotti biologici correlati. “Comitato consultivo sui vaccini e sui prodotti biologici correlati, 10 dicembre 2020, annuncio della riunione.” US Food and Drug Administration , fda.gov, 10 dicembre 2020,www.fda.gov/advisory-committees/advisory-committee-calendar/vaccines-and-lated-biological-products-advisory-committee-december-10-2020-meeting-announcement.
[17] Pfizer. “125742_S1_M5_CRF_c4591001-1114-11141050.Pdf.” Salute pubblica e professionisti medici per la trasparenza , phmpt.org, 1 maggio 2023,phmpt.org/wp-content/uploads/2023/05/125742_S1_M5_CRF_c4591001-1114-11141050.pdf, pag. 128.
[18]https://dailyclout.io/wp-content/uploads/Follow-up-letter-Professor-Anthony-Lawler_17_5_24.pdf
[19] Michels, Corinne, et al. “Analisi forense dei 38 decessi di soggetti nel rapporto provvisorio di 6 mesi della sperimentazione clinica del vaccino Pfizer/Biontech Bnt162b2 Mrna.” International Journal of Vaccine Theory, Practice, and Research , International Journal of Vaccine Theory, Practice, and Research, 17 ottobre 2023,ijvtpr.com/index.php/IJVTPR/article/view/86.
[20] Scienza, politica di sanità pubblica e diritto. 2024. “Una revisione sistematica dei risultati dell’autopsia nei decessi dopo la vaccinazione COVID-19 – Scienza, politica di sanità pubblica.” 17 novembre 2024. https://publichealthpolicyjournal.com/a-systematic-review-of-autopsy-findings-in-deaths-after-covid-19-vaccination/.
[21] Pfizer. “125742_S1_M5_CRF_c4591001-1120-11201050.Pdf.” Salute pubblica e professionisti medici per la trasparenza , phmpt.org, 1 maggio 2023,phmpt.org/wp-content/uploads/2023/05/125742_S1_M5_CRF_c4591001-1120-11201050.pdf, pag. 74.
Dott.ssa Jeyanthi Kunadhasan
Anestesista e medico perioperatorio
Progetto di analisi dei documenti Pfizer – Team 3
https://dailyclout.io/pfizer-did-not-disclose-a-kansas-vaccinated-sudden-cardiac-death-from-its-covid-19-clinical-trial-dr-jeyanthi-kunadhasans-letter-to-kansas-attorney-general-kris-kobach/?
PO Box 24Millerton, New York 12546
Onorevole Kris Kobach
Procuratore generale del Kansas
120 SW 10th Ave, 2 ° piano
Topeka, Kansas 66612
4 dicembre 2024
OGGETTO: Morte non divulgata di un vaccinato del Kansas nel processo C4591001 presso il Vaccine and Related Biological Products Advisory Committee (VRBPAC) il 10 dicembre 2020
Egregio Procuratore Generale Kobach:
Mi chiamo Dott.ssa Jeyanthi Kunadhasan e sono un'anestesista e un medico perioperatorio in Australia. Sono anche un membro del team di volontari DailyClout che sta esaminando i dati, pubblicati sul sito web Public Health and Medical Professionals for Transparency[1], che hanno costituito la base dell'autorizzazione all'uso di emergenza (EUA) della Food and Drug Administration per il vaccino COVID-19 a mRNA BNT162b2 di Pfizer-BioNTech. Inoltre, sono tesoriere dell'Australian Medical Professionals Society.[2]
Ho co-scritto i report di analisi dei documenti Pfizer di WarRoom/DailyClout42[3] e76[4] , disponibile su dailyclout.io. Sono anche coautore di “Analisi forense dei 38 decessi di soggetti nel rapporto provvisorio di 6 mesi della sperimentazione clinica del vaccino mRNA BNT162b2 di Pfizer-BioNTech,”[5] che è la prima analisi dei dati originali del trial del vaccino mRNA BNT162b2 di Pfizer-BioNTech da parte di un gruppo non affiliato allo sponsor del trial clinico.
Ho notato con interesse la vostra causa contro Pfizer. Vorrei richiamare la vostra attenzione su un decesso non divulgato di un partecipante del Kansas, avvenuto nel braccio vaccinato con BNT162b2 della sperimentazione clinica di Pfizer, come originariamente riportato nel War Room/DailyClout Report 89, 'I ricercatori scoprono che Pfizer ha ritardato la registrazione dei decessi dei vaccinati in un momento critico del processo EUA. Ritardi impropri nella segnalazione dei decessi dei vaccinati hanno portato la FDA a dichiarare erroneamente l'efficacia del vaccino, influenzando la decisione di concessione dell'EUA.'[6]
Come saprete, i risultati dello studio clinico C4591001, che presumibilmente supportano la sicurezza e l'efficacia del vaccino a mRNA BNT162b2, sono stati pubblicati due volte. Polack et al. hanno pubblicato per la prima volta i risultati il 10 dicembre 2020, un giorno prima dell'emissione dell'EUA da parte della FDA, intitolata "Sicurezza ed efficacia del vaccino Covid-19 a mRNA BNT162b2”[7]. Quindi, il 15 settembre 2021, Stephen J. Thomas, MD, et al. hanno pubblicato, “Sicurezza ed efficacia del vaccino Covid-19 a mRNA BNT162b2 a 6 mesi.”[8] La pubblicazione Polack NEJM ha affermato, “Tutti i dati della sperimentazione erano disponibili a tutti gli autori, che ne garantiscono l’accuratezza e la completezza e l’aderenza della sperimentazione al protocollo, che è disponibile con il testo completo di questo articolo su NEJM.org. Un comitato indipendente di monitoraggio dei dati e della sicurezza ha esaminato l’efficacia e i dati di sicurezza non in cieco.” (Polack et al., 2020)
Il documento di Polack ha rivelato sei decessi : due nel braccio BNT162b2 e quattro nel braccio Placebo. Nell'articolo della rivista e nella documentazione di approvazione EUA[9], i sei decessi coprivano il periodo dal 27 luglio 2020 al 14 novembre 2020. Questa lettera dimostrerà che Pfizer-BioNTech possedeva registrazioni che mostravano che otto decessi , quattro nel braccio BNT162b2 e quattro nel braccio Placebo, avrebbero dovuto essere divulgati da Pfizer alla FDA. Inoltre, i due decessi non divulgati presentavano un segnale di evento cardiaco nei destinatari BNT162b2 della sperimentazione clinica. Uno dei decessi non divulgati nel braccio vaccinato della sperimentazione si è verificato in Kansas.
Il protocollo di sperimentazione clinica di Pfizer richiedeva che gli eventi avversi gravi (SAE) fossero segnalati immediatamente dopo la presa di coscienza e in nessun caso oltre le 24 ore, a Pfizer Safety sul Vaccine SAE Reporting Form.[10] Il protocollo richiedeva agli investigatori del sito di registrare nel Case Report Form (CRF) del paziente tutti gli eventi avversi osservati direttamente e tutti gli eventi avversi segnalati spontaneamente e gli eventi avversi gravi segnalati dal partecipante. In caso di decesso, ci si affidava al parente più prossimo/contatto di emergenza per informare un sito di sperimentazione clinica del decesso di un partecipante, a differenza dell'auto-segnalazione di altri eventi avversi. La tempestiva notifica allo sponsor della sperimentazione, da parte dell'investigatore del sito di sperimentazione clinica, di un SAE era essenziale per soddisfare gli obblighi legali e le responsabilità etiche in merito alla sicurezza dei partecipanti e alla sicurezza di un intervento di studio in fase di indagine clinica. Lo sponsor, in questo caso BioNTech, aveva la responsabilità legale di notificare sia all'autorità di regolamentazione locale che ad altre agenzie di regolamentazione la sicurezza dell'intervento di studio in fase di indagine clinica. Lo sponsor era tenuto a rispettare i requisiti normativi specifici del Paese in relazione alla segnalazione di sicurezza all'autorità di regolamentazione, ai comitati di revisione indipendente (IRB)/comitati etici (CE) e agli investigatori.
Quando osserviamo la tabella sottostante, che è adattata da "Analisi forense dei 38 decessi di soggetti nel rapporto intermedio a 6 mesi dello studio clinico sul vaccino a mRNA BNT162b2 Pfizer/BioNTech") (Michels et al., 2023), possiamo vedere che, fino alla data di cutoff dei dati del 14 novembre 2020, si sono verificati 11 decessi (sei decessi nel braccio vaccinato dello studio e cinque nel braccio placebo) in contrasto con i sei decessi resi pubblici alla riunione del VRBPAC e nell'articolo di Polack. Apparentemente c'era un tasso di cattura del 33% (due decessi segnalati su sei decessi) nel braccio vaccinato rispetto a un tasso di cattura dell'80% nel braccio placebo (quattro decessi segnalati su cinque decessi).
 |
I due soggetti BNT162b2 i cui decessi sono stati inclusi nella presentazione dell'EUA:
 |
 |
Tuttavia, i dati Pfizer-BioNTech di settembre 2023 pubblicati dalla FDA hanno fornito un documento intitolato "125742_S1_M5_5351_c4591001-interim-mth6-narrativa-sensibile.pdf”[11] che includeva informazioni che mostravano che Pfizer-BioNTech era stata, di fatto, informata di due decessi aggiuntivi nel braccio BNT162b2 della sperimentazione ben prima del cutoff dei dati EUA e che tali decessi non erano stati divulgati alla FDA. Se i due decessi aggiuntivi fossero stati divulgati al momento dell'EUA, ciò avrebbe dimostrato che l'intervento del vaccino COVID mRNA BNT162b2 non aveva fornito alcuna riduzione dei decessi .
Il soggetto 11141050, una donna di 63 anni, si è iscritto alla sperimentazione del vaccino Pfizer (C4591001) presso l'Alliance for Multispecialty Research LLC, a Newton, Harvey County, 67114 Kansas. Il ricercatore principale in questo sito era il dottor Richard Glover.[12]
Il soggetto 11141050 era leggermente sovrappeso, con un BMI di 27. Era in postmenopausa, soffriva di depressione, ipertensione, osteoporosi, artrite reumatoide e apnea notturna. I suoi farmaci includevano trazodone (dal 1° gennaio 2005) e sertralina (dal 1° luglio 2020) per la depressione; pregabalin (dal 1° gennaio 2005) e baclofen (dal 1° gennaio 2018) per la malattia degenerativa del disco; così come amlodipina (dal 1° gennaio 2010) e idralazina (dal 1° febbraio 2020) per l'ipertensione.[13]
Dopo aver completato il processo di screening e i test appropriati, ha ricevuto la sua prima dose di BNT162b2 il 18 agosto 2020 e la seconda dose l'8 settembre 2020. Si è presentata per il follow-up di un mese, dopo la seconda dose, il 7 ottobre 2020 e in quel momento le sono stati eseguiti i test di follow-up appropriati.[14] Non vi è alcuna documentazione di eventi clinici indesiderati durante queste visite.
È morta 41 giorni dopo aver ricevuto la dose 2 di BNT162b2 il 19 ottobre 2020 e solo 12 giorni dopo la visita di controllo programmata. Il contatto di emergenza ha informato il sito clinico del decesso il 19 ottobre 2020. [15]
La morte di questo soggetto non è stata divulgata nella pubblicazione Polack NEJM (Polack et al., 2020), né durante la riunione del VRBPAC del 10 dicembre 2020.[16] Il protocollo di sperimentazione clinica della stessa Pfizer-BioNTech indicava che avrebbe dovuto essere divulgata.
Il decesso è avvenuto ben prima della data limite dei dati del 14 novembre 2020. Nelle narrazioni dei pazienti (Pfizer, 2023, p. 71), si può vedere che il contatto di emergenza ha confermato il giorno del decesso (19 ottobre 2020) che il soggetto era morto . I documenti narrativi affermano inoltre che il soggetto è stato sottoposto ad autopsia, da cui è stata determinata la causa della morte come "morte cardiaca improvvisa".
Quando ho esaminato il Case Report Form (CRF) di questo soggetto, ho scoperto che la diagnosi specifica di "morte cardiaca improvvisa" era stata menzionata il 9 dicembre 2020.[17] A pagina 71 del CRF di questo soggetto, la data di notifica del decesso è il 25 novembre 2020. Poiché il sito clinico era stato informato dal contatto di emergenza il giorno in cui il paziente è morto, vediamo che c'è stato un ritardo di 37 giorni nella registrazione di questo decesso nel CRF, in violazione del protocollo di sperimentazione di Pfizer. Poiché questo decesso si è verificato ben prima della data di interruzione dei dati del 14 novembre 2020 ed era noto il 25 novembre 2020, c'erano ampie opportunità di divulgare il decesso di questo soggetto, e possibilmente i risultati dell'autopsia, alla riunione del VRBPAC del 10 dicembre 2020.
Secondo l'autopsia, la paziente è morta per "morte cardiaca improvvisa", con i suoi noti fattori di rischio di ipertensione e obesità che la esponevano ad alto rischio di infarto miocardico acuto cardiaco. Il personale del sito clinico ha inserito la diagnosi specifica di "morte cardiaca improvvisa" nelle sue note il 9 dicembre 2020, il giorno prima della riunione del VRBPAC del 10 dicembre 2020, il che suggerisce che questa morte nascosta aveva anche i risultati dell'autopsia disponibili nel momento critico della considerazione dell'autorizzazione all'uso di emergenza del vaccino.
 |
 |
Per essere ammissibili all'inclusione in questo studio clinico, i partecipanti dovevano essere considerati sani in base alla storia clinica, all'esame fisico (se richiesto) e al giudizio clinico dell'investigatore. Il protocollo ha consentito ai partecipanti sani con malattia stabile preesistente, definita come malattia che non richiedeva un cambiamento significativo nella terapia o l'ospedalizzazione per peggioramento della malattia durante le sei settimane precedenti l'arruolamento, di partecipare allo studio clinico. Questa paziente era stata curata con due diversi antipertensivi e aveva incontrato il personale dello studio clinico almeno tre volte senza alcuna menzione di letture di pressione sanguigna preoccupantemente elevate. Infatti, non riesco a trovare alcuna lettura della pressione sanguigna nelle sue note del caso disponibili al pubblico. Di conseguenza, posso solo supporre che l'ipertensione della paziente, di cui soffriva dal 1° gennaio 2010, fosse ben controllata quando è stata ammessa allo studio.
La paziente era alta 165 cm e pesava 74,1 kg. Quindi, il suo BMI di 27,2 la collocava nella categoria sovrappeso, non obesa. Senza esaminare i risultati dell'autopsia, sarà difficile credere che tali letture antropometriche mettano una persona ad alto rischio di morte cardiaca improvvisa.
 |
Sono necessarie ulteriori indagini sulla conclusione dello sponsor clinico secondo cui questa morte non divulgata nel braccio vaccinato non era dovuta al vaccino. Su quale base è stata presa questa decisione? Questo paziente ha un risultato dell'autopsia che non è ancora disponibile al pubblico. Questa autopsia non è stata divulgata nel momento più critico, prima dell'autorizzazione del farmaco. I risultati di questa autopsia devono essere resi pubblici per l'esame da parte di esperti indipendenti.
È estremamente importante sapereQuando il sito clinico 1114 ha ricevuto la notifica del decesso e se è stata effettuata una notifica tempestiva allo sponsor della sperimentazione clinica, Pfizer-BioNTech.
Quando è stata eseguita l'autopsia, chi è stato informato dei risultati della morte cardiaca improvvisa e quando.
Perché questo decesso (avvenuto ben prima del periodo di riferimento) e i risultati dell'autopsia non sono stati resi pubblici durante la riunione del VRBPAC del 10 dicembre 2020.
Di seguito è riportato un semplice diagramma schematico che evidenzia le date importanti per questo argomento di sperimentazione.
 |
Le autopsie, o meglio la mancanza di autopsie, in questo studio diventano più pertinenti considerando la revisione sistematica recentemente pubblicata dei risultati delle autopsie nei decessi dopo la vaccinazione contro il COVID-19. Ha rilevato che il 73,9% dei decessi è stato giudicato indipendentemente come direttamente dovuto alla vaccinazione, di cui la causa primaria di morte includeva la morte cardiaca improvvisa nel 35%. [20]
Voglio anche evidenziare un altro decesso non divulgato di un soggetto vaccinato. Il soggetto 11201050, di Meridian Clinical Research LLC, Savannah, Georgia, è morto il 7 novembre 2020. Le narrazioni del paziente affermano esplicitamente che il sito clinico ha ricevuto la notifica del decesso del soggetto il 7 novembre 2020 da suo marito(Pfizer2023, p. 75) . Questa informazione è ulteriormente supportata dalla documentazione trovata nel CRF di quel paziente che afferma chiaramente che la notifica di morte è avvenuta il 7 novembre 2020.[21]
Durante la riunione del VRBPAC del 10 dicembre 2020, una delle ragioni citate per l'approvazione del vaccino è stata che i benefici noti e potenziali del vaccino superano i rischi noti e potenziali del vaccino quando utilizzato per l'immunizzazione attiva per prevenire il COVID-19 causato da SARS-CoV-2 in individui di età pari o superiore a 16 anni (Comitato consultivo sui vaccini e sui prodotti biologici correlati, 2020). In particolare, l'omissione dei decessi e del rapporto dell'autopsia dal braccio vaccinato dello studio in questa fase critica dell'emissione dell'EUA solleva notevoli preoccupazioni sulla segnalazione complessiva della sicurezza della sperimentazione clinica di Pfizer. I pazienti che si sono offerti volontari per la sperimentazione clinica probabilmente lo hanno fatto, almeno in parte, al servizio dell'umanità. La mancata divulgazione dei decessi dei pazienti, nonostante la tempestiva notifica da parte dei propri cari, costituisce un tradimento del loro altruismo e della loro fiducia e merita ulteriori indagini. Solleva inoltre notevoli dubbi sui metodi di segnalazione complessivi. Questi metodi hanno portato a spese medico-finanziarie mai viste al mondo, e forse basate su premesse del tutto errate.
Sinceramente,
Dott.ssa Jeyanthi Kunadhasan
MD (UKM) MMed (AnaesUM) FANZCA MMED (Monash)
Note
[1] “Pfizer 16+ Documents.” Salute pubblica e professionisti medici per la trasparenza , Food and Drug Administration, 17 febbraio 2021,phmpt.org/pfizer-16-plus-documents/.
[2] “Australian Medical Professionals' Society: una società per i professionisti medici australiani.” AMPS , AMPS,amps.redunion.com.au/. Consultato il 31 dicembre 2023.
[3] Kunadhasan, Jeyanthi, et al. “Report 42: EUA di Pfizer concessa in base a meno dello 0,4% dei partecipanti alla sperimentazione clinica. La FDA ha ignorato le deviazioni del protocollo di squalifica per concedere l'EUA.” DailyClout , DailyClout, 26 settembre 2022,dailyclout.io/report-41-the-170-clinical-trial-participants-who-changed-the-world-pfizer-ignored-protocol-deviations-to-obtain-emergency-use-authorization-for-its-covid- Vaccino 19-mrna/.
[4] Kunadhasan, Jeyanthi e Ed Clark. “Report 76: Pfizer aveva i dati per annunciare la presunta "efficacia" del suo vaccino COVID-19 nell'ottobre 2020. Perché Pfizer ha ritardato l'annuncio fino al 9 novembre 2020, sei giorni dopo le elezioni presidenziali statunitensi del 2020?” DailyClout , DailyClout, 10 luglio 2023,dailyclout.io/report-76-pfizer-had-necessary-data-to-announce-its-covid-19-vaccines-alleged-efficacy-in-october-2020-why-did-pfizer-delay/.
[5] Michels, Corinne, et al. “Analisi forense dei 38 decessi di soggetti nel rapporto provvisorio di 6 mesi della sperimentazione clinica del vaccino Pfizer/Biontech Bnt162b2 Mrna.” International Journal of Vaccine Theory, Practice, and Research , International Journal of Vaccine Theory, Practice, and Research, 17 ottobre 2023,ijvtpr.com/index.php/IJVTPR/article/view/86.
[6]https://dailyclout.io/fda-granted-pfizer-eua-based-on-misrepresented-data/
[7] Polack, Fernando, et al. “Sicurezza ed efficacia del vaccino BNT162B2 Mrna Covid-19.” New England Journal of Medicine , nejm.org, 10 dicembre 2020,www.nejm.org/doi/full/10.1056/NEJMoa2034577.
[8] Thomas, Stephen J., et al. “Sicurezza ed efficacia del vaccino BNT162B2 Mrna Covid-19 a 6 mesi.” New England Journal of Medicine , nejm.org, 15 settembre 2021,www.nejm.org/doi/full/10.1056/NEJMoa2110345.
[9] Naik, Ramachandra, et al. “Memorandum di revisione dell’autorizzazione all’uso di emergenza del vaccino Pfizer-BioNTech COVID-19.” FDA , fda.gov, 20 novembre 2020,www.fda.gov/media/144416/download, pag. 19.
[10] Pfizer. “UNO STUDIO DI FASE 1/2/3, CONTROLLATO CON PLACEBO, RANDOMIZZATO, IN CIECO PER L'OSSERVATORE, PER VALUTARE LA SICUREZZA, LA TOLLERABILITÀ, L'IMMUNOGENICITÀ E L'EFFICACIA DEI CANDIDATI VACCINI A RNA SARS-COV-2 CONTRO IL COVID-19 IN SOGGETTI SANI.” Salute pubblica e professionisti medici per la trasparenza , PHMPT.org, 1 marzo 2022,phmpt.org/wp-content/uploads/2022/03/125742_S1_M5_5351_c4591001-fa-interim-protocol.pdf, pag. 74.
[11] Pfizer. “125742_S1_M5_5351_c4591001-Interim-Mth6-Narrative-Sensitive.Pdf.” Salute pubblica e professionisti medici per la trasparenza , phmpt.org, 1 settembre 2023,phmpt.org/wp-content/uploads/2023/09/125742_S1_M5_5351_c4591001-interim-mth6-narrative-sensitive.pdf.
[12]https://phmpt.org/wp-content/uploads/2021/11/5.2-listing-of-clinical-sites-and-cvs-pages-1-41.pdf#page=18.
[13]https://phmpt.org/wp-content/uploads/2023/09/125742_S1_M5_5351_c4591001-interim-mth6-narrative-sensitive.pdf, pag. 69.
[14]https://phmpt.org/wp-content/uploads/2023/05/125742_S1_M5_CRF_c4591001-1114-11141050.pdf, pag. 23.
[15]https://phmpt.org/wp-content/uploads/2023/09/125742_S1_M5_5351_c4591001-interim-mth6-narrative-sensitive.pdf, pag. 71.
[16] Comitato consultivo sui vaccini e sui prodotti biologici correlati. “Comitato consultivo sui vaccini e sui prodotti biologici correlati, 10 dicembre 2020, annuncio della riunione.” US Food and Drug Administration , fda.gov, 10 dicembre 2020,www.fda.gov/advisory-committees/advisory-committee-calendar/vaccines-and-lated-biological-products-advisory-committee-december-10-2020-meeting-announcement.
[17] Pfizer. “125742_S1_M5_CRF_c4591001-1114-11141050.Pdf.” Salute pubblica e professionisti medici per la trasparenza , phmpt.org, 1 maggio 2023,phmpt.org/wp-content/uploads/2023/05/125742_S1_M5_CRF_c4591001-1114-11141050.pdf, pag. 128.
[18]https://dailyclout.io/wp-content/uploads/Follow-up-letter-Professor-Anthony-Lawler_17_5_24.pdf
[19] Michels, Corinne, et al. “Analisi forense dei 38 decessi di soggetti nel rapporto provvisorio di 6 mesi della sperimentazione clinica del vaccino Pfizer/Biontech Bnt162b2 Mrna.” International Journal of Vaccine Theory, Practice, and Research , International Journal of Vaccine Theory, Practice, and Research, 17 ottobre 2023,ijvtpr.com/index.php/IJVTPR/article/view/86.
[20] Scienza, politica di sanità pubblica e diritto. 2024. “Una revisione sistematica dei risultati dell’autopsia nei decessi dopo la vaccinazione COVID-19 – Scienza, politica di sanità pubblica.” 17 novembre 2024. https://publichealthpolicyjournal.com/a-systematic-review-of-autopsy-findings-in-deaths-after-covid-19-vaccination/.
[21] Pfizer. “125742_S1_M5_CRF_c4591001-1120-11201050.Pdf.” Salute pubblica e professionisti medici per la trasparenza , phmpt.org, 1 maggio 2023,phmpt.org/wp-content/uploads/2023/05/125742_S1_M5_CRF_c4591001-1120-11201050.pdf, pag. 74.









Nessun commento:
Posta un commento